
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肠道菌群失调通过LPS-TLR4/NF-κB信号轴加剧心力衰竭的机制研究及TLR4抑制剂的治疗潜力
【字体: 大 中 小 】 时间:2025年07月11日 来源:Journal of Translational Medicine 6.1
编辑推荐:
本研究针对心力衰竭(HF)患者死亡率居高不下的临床难题,揭示了肠道菌群失调通过LPS-TLR4/NF-κB信号通路加剧心肌炎症的关键机制。研究人员通过ISO诱导的心衰大鼠模型,结合16S rRNA测序和TLR4抑制剂TAK-242干预,证实菌群紊乱导致内毒素(LPS)入血激活TLR4/NF-κB通路,引发IL-6、TNF-α等炎症因子风暴。该研究为心衰治疗提供了以肠道微环境为靶点的新策略,论文发表于《Journal of Translational Medicine》。
研究背景
心力衰竭作为全球公共卫生难题,尽管现有药物治疗和介入手段不断进步,患者死亡率仍居高不下。近年研究发现,慢性炎症反应是推动心衰进展的"隐形推手"——当免疫系统持续过度激活时,本应参与组织修复的炎症反应反而会加速心肌纤维化,最终导致心脏收缩舒张功能恶化。与此同时,肠道这个"第二大脑"与心脏的隐秘对话逐渐浮出水面:心衰患者普遍存在肠道屏障损伤,使得革兰阴性菌的细胞壁成分脂多糖(LPS)突破防线进入血液,如同特洛伊木马般激活全身炎症。然而,肠道菌群究竟如何"遥控"心肌炎症?这个关键科学问题亟待破解。
为揭开这一谜团,皖南医学院第二附属医院心血管内科张春雷团队联合呼吸科、血管疾病研究中心的多学科力量,在《Journal of Translational Medicine》发表了一项突破性研究。他们创新性地将微生物组学与心血管病理机制相结合,首次系统阐释了"肠-心轴"中LPS-TLR4/NF-κB信号通路的桥梁作用,并为临床转化提供了特异性靶点。
关键技术方法
研究采用ISO诱导的心衰大鼠模型,通过小动物超声评估心功能指标(LVEF、LVFS等),ELISA检测血清BNP和炎症因子,Western blot分析TLR4/NF-κB通路蛋白表达,16S rRNA测序解析肠道菌群结构。创新性引入TLR4抑制剂TAK-242进行干预,结合HE/Masson染色观察心肌病理改变。
主要研究结果
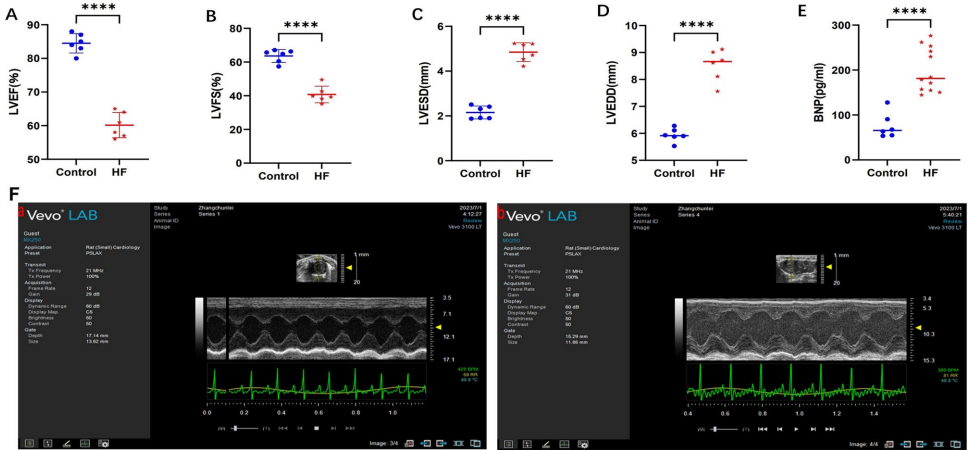
1. 心衰模型验证与菌群特征
通过低剂量ISO(3 mg/kg/d)连续14天注射成功构建心衰模型,大鼠LVEF显著降低至53.6±2.5%(对照组81.3±5.5%),血清BNP水平倍增。16S rRNA测序显示心衰组菌群多样性下降1.5倍,拟杆菌门(Bacteroidota)相对丰度增加38.7%,伴随血清LPS水平升高至2.33±0.53 ng/mL(对照组0.98±0.29 ng/mL)。
2. 炎症风暴与心肌损伤
心衰组血清IL-1β、IL-6、TNF-α等炎症因子水平激增,心肌组织出现淋巴细胞浸润和28.5±3.7%的纤维化区域(对照组8.2±1.5%)。Western blot显示TLR4表达增加3.2倍,核因子κB(NF-κB)p65亚基磷酸化水平升高4.1倍。
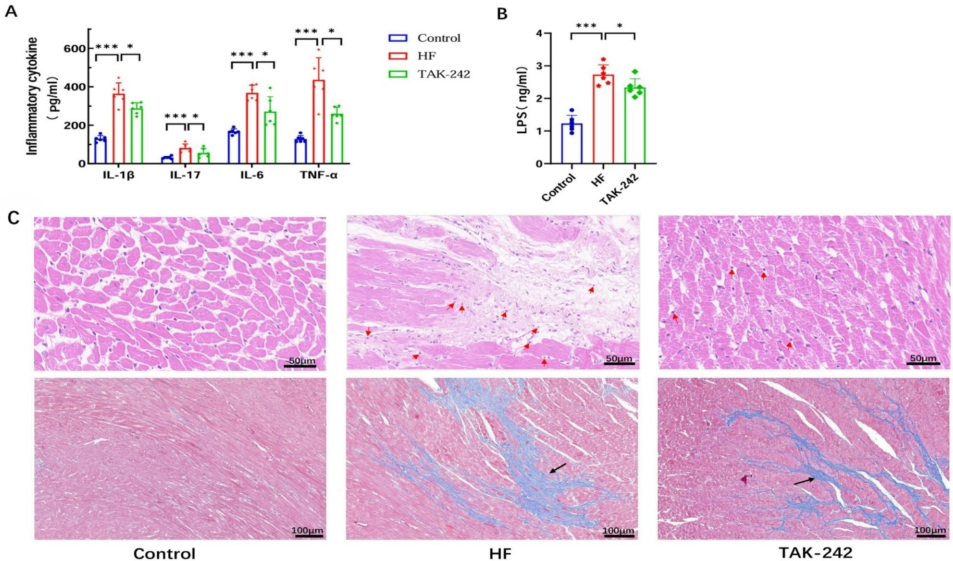
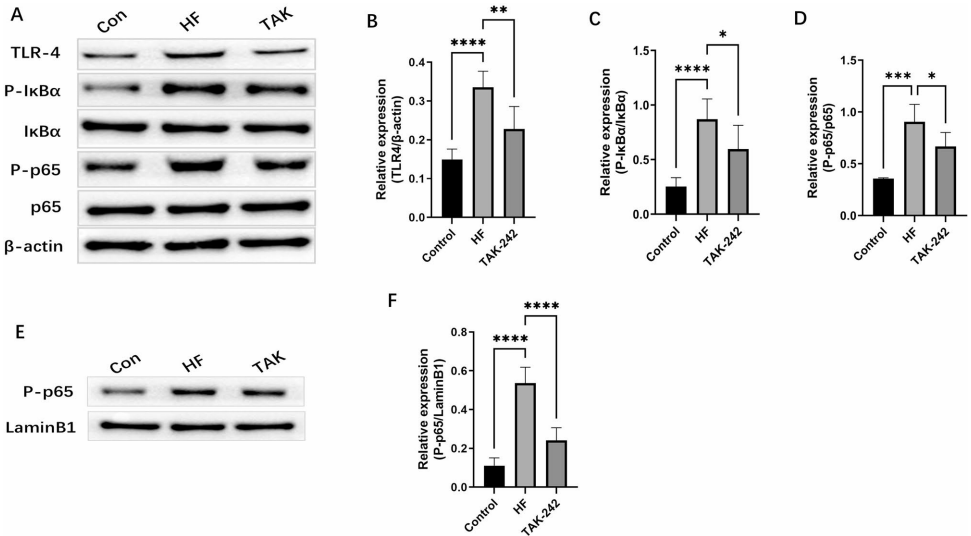
3. TAK-242的干预效果
TLR4抑制剂TAK-242治疗10天后,LVEF回升至61.9±3.1%,纤维化面积减少58.3%。菌群分析显示拟杆菌门丰度恢复至基线水平,Muribaculaceae等促炎菌科显著减少。机制上,TAK-242使p65磷酸化水平降低73.2%,IkBα降解减少2.1倍。
研究结论与意义
该研究首次完整描绘了"肠道菌群失调-LPS释放-TLR4/NF-κB通路激活-心肌炎症-心功能恶化"的因果链条,突破性地证实:① 特定菌群结构变化(如拟杆菌门富集)可作为心衰进展的生物标志物;② TLR4抑制剂通过双重机制(抗炎+菌群调节)改善心功能,为临床转化提供新选择;③ 为"肠-心轴"理论补充了分子层面的机制解释。
研究局限性包括动物模型与人类慢性心衰的差异,未来需通过粪便菌群移植验证特定菌属的致病性。临床转化方面,TAK-242已进入脓毒症治疗的II期临床试验,其在心衰领域的应用值得期待。这项研究为开发以肠道微生态为靶点的"菌群-免疫-心脏"三联疗法奠定了理论基础,可能引领心衰治疗模式的革新。
 生物通微信公众号
生物通微信公众号
知名企业招聘