
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:线粒体功能障碍与衰老的多维机制及治疗策略
【字体: 大 中 小 】 时间:2025年07月11日 来源:Biogerontology 4.4
编辑推荐:
这篇综述系统阐述了线粒体功能障碍通过代谢重编程(如PI3K/Akt/mTOR通路异常)、表观遗传调控(SIRT1/3-PGC-1α轴)、端粒损伤(p53-PGC-1α通路)、自噬失衡(PINK1/Parkin介导的线粒体自噬)及衰老相关分泌表型(SASP/cGAS-STING炎症通路)等多维机制驱动衰老的分子路径,为延缓衰老和防治年龄相关疾病(如心血管病、神经退行性疾病)提供了靶向干预新思路。
衰老是多种疾病发展的核心病理基础,其本质是细胞结构与功能的渐进性损伤。随着全球老龄化加剧,探索衰老机制成为迫切需求。线粒体作为细胞能量工厂,其功能障碍通过多维机制加速衰老进程,成为抗衰老研究的关键靶点。
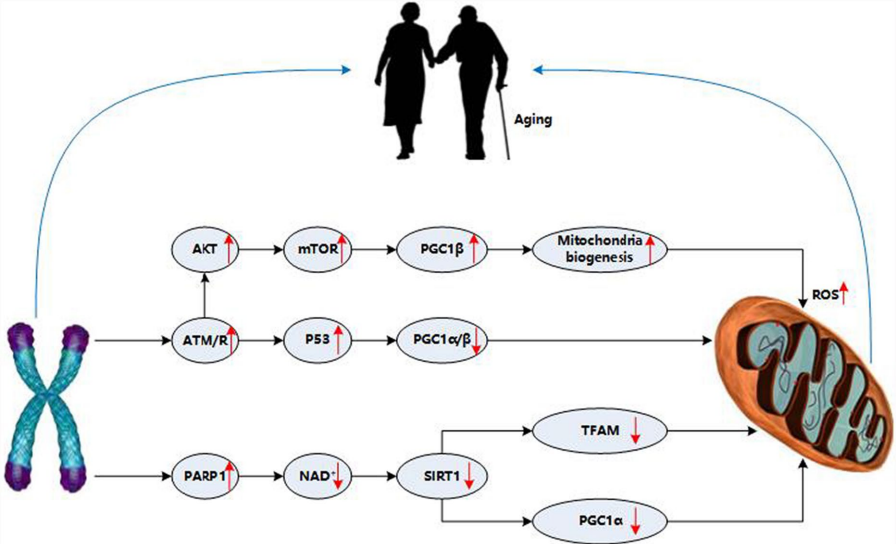
衰老细胞表现出显著的代谢重塑特征:糖代谢从氧化磷酸化(OXPHOS)向糖酵解偏移,表现为GLUT1和HK2表达上调,而丙酮酸脱氢酶复合体(PDHC)活性降低。这种"瓦氏效应"的衰老版本由PI3K/AKT/mTOR通路过度激活驱动,导致线粒体膜电位下降和ROS累积。
脂代谢重编程则呈现脂肪酸合成(ACLY介导)与β-氧化(CPT1下调)的失衡,脂滴堆积产生的4-HNE等醛类物质进一步损伤线粒体膜。SIRT1/PGC-1α轴在此发挥关键调控作用——SIRT1通过去乙酰化激活PGC-1α,促进线粒体生物合成,而衰老相关的NAD+水平下降会破坏这一保护机制。
氨基酸代谢中,谷氨酰胺代谢通过ME1途径维持NADPH池,抵消氧化压力。但衰老导致的代谢紊乱会激活mTOR通路,形成"线粒体损伤-代谢异常-炎症放大"的恶性循环。

表观遗传修饰构成衰老的"第二层密码":DNA甲基化随年龄呈现整体低甲基化与特定基因(如p16)高甲基化并存;组蛋白修饰中,SIRT3等NAD+依赖性去乙酰化酶活性下降,导致H3K9ac等激活标记减少,异染色质丢失。线粒体代谢物(如α-KG)可直接调节组蛋白去甲基化酶活性,形成代谢-表观遗传交叉对话。
非编码RNA网络(如miR-30、lncRNA)通过调控SASP因子表达放大衰老信号。染色质重塑复合物(如SWI/SNF)的失调则导致衰老相关基因异常开放,其中BRG1缺失可诱导间充质干细胞衰老。
端粒缩短通过三条通路影响线粒体:
心脏衰老研究显示,端粒锚定的DNA损伤灶(TAFs)独立于端粒长度出现,通过FOXC1网络诱发心肌收缩功能障碍。而线粒体ROS又可反馈加速端粒磨损,形成双向恶化循环。
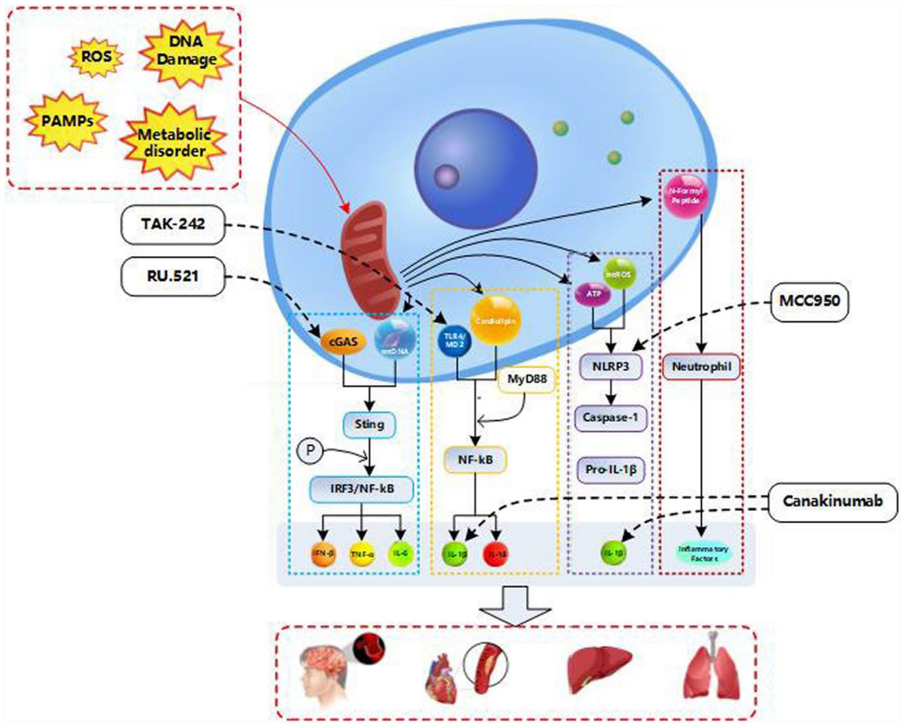
线粒体自噬通过PINK1-Parkin通路清除受损线粒体,但过度激活可能诱发凋亡。衰老过程中,VPS35等蛋白缺陷导致自噬溶酶体效率下降,无法有效清除线粒体来源的染色质片段(CCFs),进而通过cGAS-STING通路激活SASP。
mTOR是调控自噬的核心枢纽:
线粒体损伤释放的mtDNA/mtROS(mtDAMPs)通过cGAS-STING-NF-κB通路驱动IL-6、IL-8等SASP因子分泌。mTOR通过三重机制放大这一过程:
抗衰老药物开发聚焦三大方向:
临床前研究显示,二甲双胍可能通过调节SASP延缓心血管衰老。未来需结合多组学技术解析线粒体-内质网-溶酶体网络,开发针对SIRT3、端粒酶等的精准干预方案。
线粒体功能障碍与衰老构成复杂的双向调控网络。整合代谢重编程调控、表观遗传修饰干预及SASP抑制的联合疗法,将为抗衰老治疗提供新范式。特别需要关注器官特异性衰老特征,开发靶向递送系统以克服现有senotherapeutics的毒副作用。
 生物通微信公众号
生物通微信公众号
知名企业招聘