
-

生物通官微
陪你抓住生命科技
跳动的脉搏
非小细胞肺癌来源的癌症相关成纤维细胞在体外培养中发生表型漂移的机制研究及其临床意义
【字体: 大 中 小 】 时间:2025年07月11日 来源:BJC Reports
编辑推荐:
本研究针对非小细胞肺癌(NSCLC)微环境中癌症相关成纤维细胞(CAFs)体外培养的表型不稳定性问题,通过多组学分析揭示了常规培养条件下CAFs向CAF-S3亚型趋同的规律。爱丁堡大学团队发现培养至第3代时,CAFs与正常肺成纤维细胞(NFs)在表面标志物(FAP/αSMA/PDPN)、转录组(PI3K-Akt/HIF-1通路)和功能(迁移/收缩能力)层面均发生显著趋同,为优化CAFs研究模型提供了重要依据。该成果发表于《BJC Reports》,对肿瘤微环境研究具有方法论指导价值。
在肿瘤微环境研究中,癌症相关成纤维细胞(CAFs)作为最丰富的间质细胞,其异质性与肿瘤进展、治疗抵抗密切相关。然而当这些细胞离开原生环境进入培养皿后,它们的"真实面目"正在悄然改变——就像被驯服的野生动物逐渐丧失野性,这个被忽视的现象可能严重影响实验结论的可靠性。非小细胞肺癌(NSCLC)领域尤其需要解决这个难题,因为CAFs亚型分布已被证实具有预后价值,但现有培养体系能否保持这种异质性仍是未知数。
爱丁堡大学(University of Edinburgh)的研究团队在《BJC Reports》发表了一项揭示性研究。他们通过追踪11例NSCLC患者配对的肿瘤和癌旁组织来源成纤维细胞,首次系统描绘了常规培养条件下CAFs的"变形记"。令人惊讶的是,原本在体内泾渭分明的五种CAF亚型(CAF S1-S5),在培养至第3代时竟有80%以上统一"换装"为CAF-S3表型,这种表达FAPLowCD29MedαSMANeg-Low的温和激活状态,与癌旁组织成纤维细胞的特征惊人相似。
研究团队运用三大关键技术:流式细胞术动态监测8种表面标志物(FAP/αSMA/PDPN/CD29等)表达变化;纳米弦(nCounter)转录组分析揭示PI3K-Akt和HIF-1信号通路激活;功能实验(Transwell迁移/胶原收缩/划痕愈合)量化细胞行为改变。所有实验均采用配对设计的原代细胞,确保数据可比性。
主要发现包括:
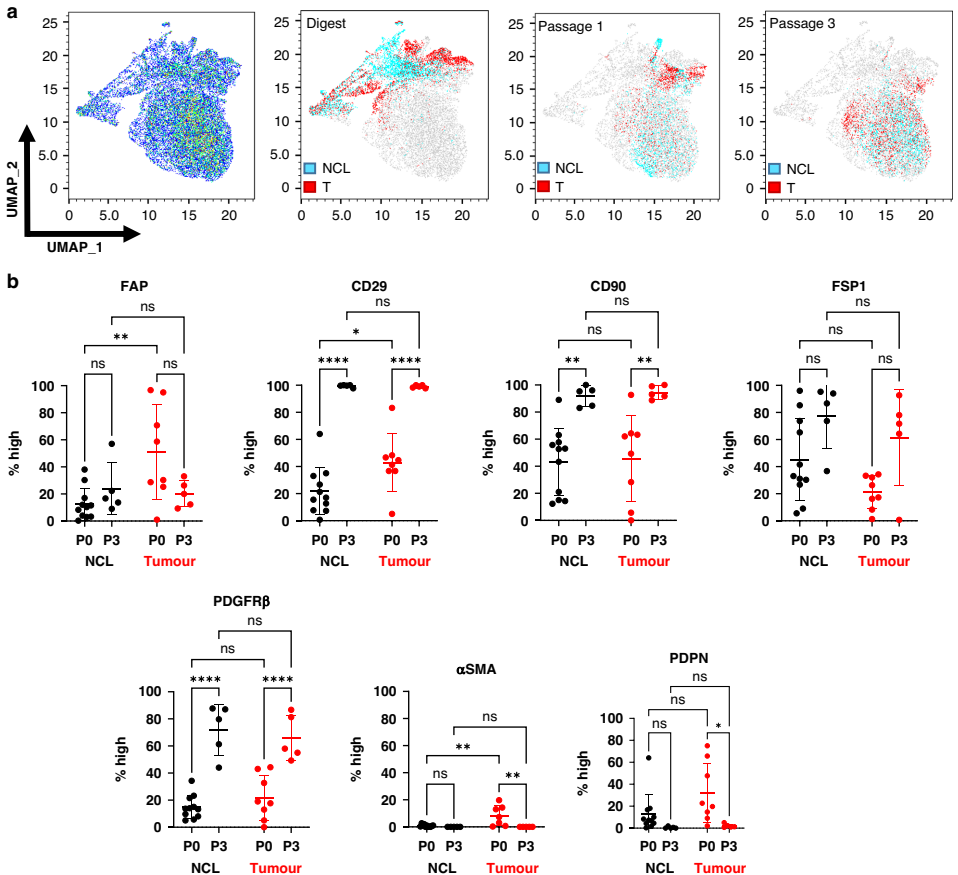
亚型分布重构:FlowSOM算法证实,初始富含CAF-S1/S4/S5的肿瘤样本和富含CAF-S3的癌旁样本,培养后CAF-S3占比均超过75%,原亚型特征几乎消失。
功能同步弱化:早期传代CAFs保持较强迁移能力(Transwell吸收值0.8±0.2),但晚期与NFs无差异(0.4±0.1);胶原收缩实验显示CAFs特有的收缩功能在培养中丧失。
分子机制线索:转录组发现TGF-β1和MMP9等促纤维化因子表达下调,而PI3K-Akt通路基因持续激活,提示培养条件可能通过代谢重编程驱动表型趋同。
这项研究的意义在于:首次明确NSCLC来源CAFs在常规培养中会发生不可逆的表型简化,这解释了为何不同实验室的CAFs研究常出现矛盾结论。更关键的是,CAF-S3表型恰好是在体研究中与较好预后相关的亚型,这意味着使用未经验证的培养细胞可能严重低估CAFs的促瘤作用。
Layla Mathieson和Ahsan R. Akram团队在讨论中指出,培养体系缺乏肿瘤细胞互作、机械应力等微环境信号是导致表型漂移的主因。他们特别强调FAP和αSMA的快速丢失值得警惕——这两个标志物正被用于多项CAF靶向治疗的开发。该研究为建立标准化CAFs培养方案提供了基准数据,未来需要探索3D培养、低氧条件等改进方法以维持CAFs异质性。这些发现不仅适用于NSCLC研究,对胰腺癌、乳腺癌等CAFs研究同样具有警示意义。
 生物通微信公众号
生物通微信公众号
知名企业招聘