
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:探索动脉粥样硬化与阿尔茨海默病的交叉点:炎症与补体激活的作用
【字体: 大 中 小 】 时间:2025年07月11日 来源:Inflammation Research 4.8
编辑推荐:
这篇综述深入探讨了动脉粥样硬化(AS)与阿尔茨海默病(AD)的共同病理机制,聚焦于炎症和补体系统(如C3、C5aR1、C1q)的激活在两种疾病中的双重作用。通过分析临床数据和动物模型,揭示了补体调控失衡如何通过Aβ(β淀粉样蛋白)清除障碍、脂代谢异常(ApoE4基因型)及神经血管单元破坏加剧疾病进展,为靶向补体通路的治疗策略提供了理论依据。
阿尔茨海默病(AD)和动脉粥样硬化(AS)均为年龄相关的炎症性疾病,共享载脂蛋白E(ApoE)基因型、氧化应激和补体激活等驱动因素。补体系统作为先天免疫的核心组分,在两种疾病的病变组织中均存在沉积,其激活具有环境依赖性——既可清除病理物质,也可能加剧组织损伤。
AD是65岁以上人群痴呆的主要病因,临床表现为进行性认知衰退,病理特征为脑内Aβ斑块和神经原纤维缠结(NFTs)的积累。ApoE4是晚发型AD最强的遗传风险因素,而补体基因(如簇集蛋白CLU、补体受体CR1)的变异也显著影响疾病进程。
AS是心血管疾病的主要病理基础,以动脉壁脂质沉积和慢性炎症为特征。低密度脂蛋白(LDL)氧化形成oxLDL,被巨噬细胞吞噬后转化为泡沫细胞,触发炎症级联反应。高密度脂蛋白(HDL)通过胆固醇逆向转运发挥保护作用,但其功能受补体调控蛋白(如因子H,FH)影响。
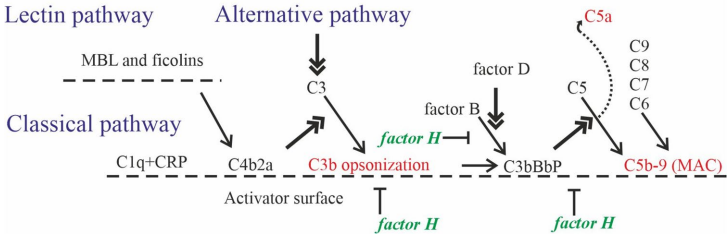
C3与CR3
C3在AD患者脑脊液和血浆中水平升高,与Aβ负荷正相关。动物模型中,C3a-C3aR信号轴通过促进小胶质细胞过度激活导致突触损伤,而C3缺失可保护神经元。在AS中,C3沉积于血管壁加剧斑块不稳定性,但全身性C3缺乏反而加速动脉粥样硬化进展,提示其功能具有组织特异性。
C5a与C5aR1
C5a通过激活C5aR1促进神经炎症和突触修剪,拮抗C5aR1可减少Aβ沉积和tau蛋白过度磷酸化。类似地,在AS模型中,C5aR1阻断减轻斑块内炎症细胞浸润,但C5a缺失小鼠仍发展AS,表明其作用复杂。
C1q的悖论
C1q在AD早期即沉积于突触,介导小胶质细胞对异常突触的清除,但过度激活导致神经损伤。相反,AS中C1q通过增强巨噬细胞抗炎表型(M2型)发挥保护作用,其缺失加速斑块形成。
补体调节蛋白
补体受体CR1和簇集蛋白(CLU)通过调控补体级联影响疾病进程。CR1促进循环中Aβ和LDL的清除,而CLU在AD脑内与Aβ共定位,可能抑制神经毒性;在AS中则通过稳定HDL功能延缓斑块发展。
高胆固醇血症通过促进Aβ生成加剧AD风险,而补体激活产物(如C1q、C3b)可同时识别Aβ聚集体和胆固醇晶体(CCs),形成正反馈循环。ApoE与补体因子H(FH)的结合形成抗补体复合物,但ApoE4与FH亲和力降低,导致补体调控失效和炎症加剧。
衰老导致补体表达上调(如C1q增加300倍)和清除能力下降,加剧神经炎症。基因层面,ApoE4和CR1多态性通过影响补体激活共同调控疾病风险。靶向补体(如C3aR拮抗剂、C5aR抑制剂)在动物模型中显示可减少Aβ沉积和斑块炎症,但需权衡其时空特异性效应。
AD与AS共享补体介导的炎症通路,但补体组分在不同组织中呈现保护或损伤的双重作用。未来需探索精准调控补体活性的策略,以平衡清除病理物质与避免过度炎症的微妙关系。

 生物通微信公众号
生物通微信公众号
知名企业招聘