
-

生物通官微
陪你抓住生命科技
跳动的脉搏
大黄素甲醚:基于TRPV1靶向的天然多模式镇痛新策略
【字体: 大 中 小 】 时间:2025年07月11日 来源:Biological Research 4.3
编辑推荐:
慢性疼痛治疗受限于非甾体抗炎药(NSAIDs)和阿片类药物的副作用。南方科技大学团队通过虚拟筛选从天然产物库中鉴定出大黄素甲醚(Physcion)作为新型TRPV1抑制剂,证实其通过抑制钙离子内流、下调NF-κB/MAPK信号通路,显著缓解醋酸扭体、热板测试、CFA炎症痛和骨癌痛模型中的疼痛行为,且不引起体温异常。该研究为开发非成瘾性镇痛药物提供了新候选分子。
慢性疼痛困扰全球数亿患者,现有镇痛药如阿片类药物易导致耐受、成瘾及呼吸抑制等风险,而NSAIDs长期使用存在胃肠道和心血管副作用。瞬时受体电位香草酸亚型1(TRPV1)作为非选择性阳离子通道,可被热、辣椒素和炎症介质激活,是疼痛传递的关键靶点。其抑制剂能阻断痛觉信号传导,且不引发中枢副作用,成为新一代镇痛药研发热点。天然产物因其结构多样性和传统应用安全性,为靶向TRPV1的药物筛选提供了宝贵资源。
南方科技大学医学院药理学系联合澳门大学、香港理工大学等团队,通过虚拟筛选技术从4013种天然小分子中锁定大黄素甲醚(Physcion),系统探究其通过TRPV1抑制和多通路调控发挥的镇痛机制,成果发表于《Biological Research》。
研究结合虚拟筛选(Vina-GPU 2.0对天然产物库L6000与TRPV1蛋白对接)、分子动力学模拟(CHARMM-GUI/GROMACS评估结合稳定性)、钙成像(Fluo-4/AM检测HEK293-hTRPV1细胞Ca2+内流)及动物行为学模型(醋酸扭体、热板、CFA炎症痛、LLC骨癌痛),并采用ELISA、qPCR和Western blot分析炎症因子与NF-κB/MAPK通路蛋白表达。
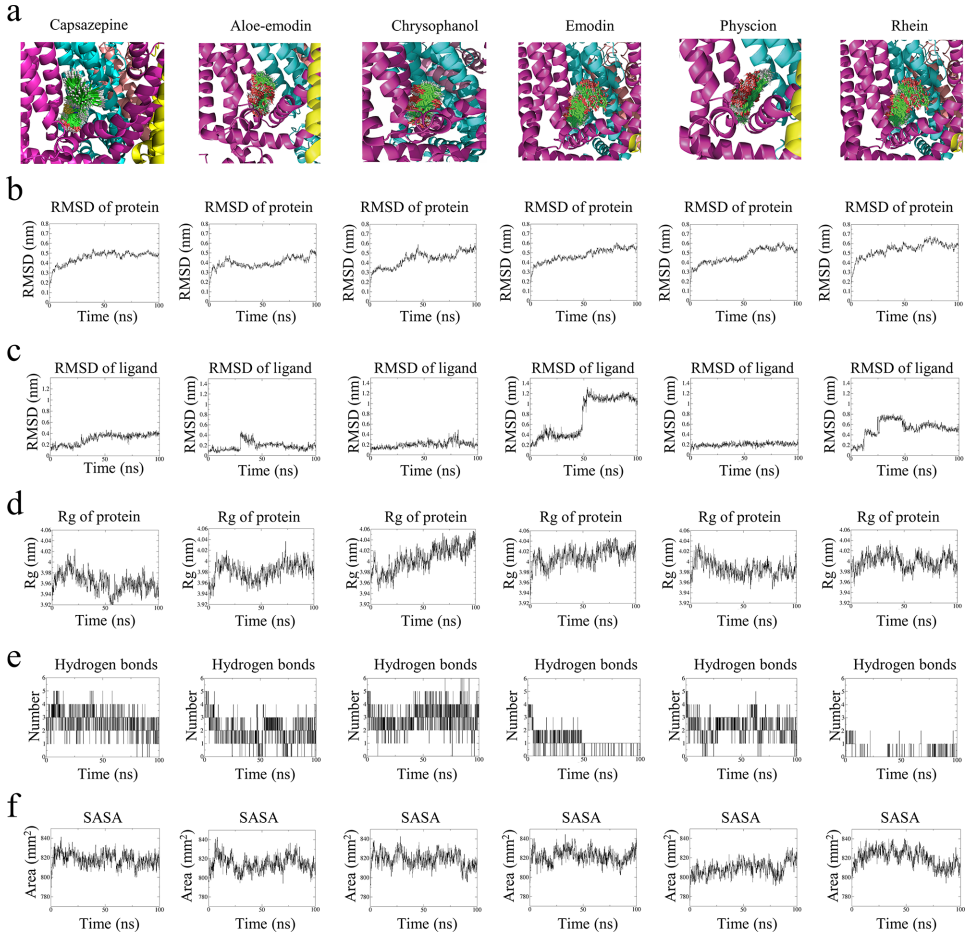
1. 虚拟筛选与分子动力学模拟验证靶向结合
通过TRPV1抑制剂囊袋(PDB:5IS0)筛选出大黄素甲醚等5个高亲和力化合物。100 ns分子动力学模拟显示,大黄素甲醚-TRPV1复合物具有最低结合自由能(-90.864 kJ/mol),RMSD值稳定(图2b-c),氢键数量(2.225)和溶剂可及表面积(809.04 nm2)表明结合紧密。其与关键抑制残基ARG557/THR550/TYR511的结合概率达95%/64.5%/58%(图3d),结合模式经AlphaFold3交叉验证(图S1)。

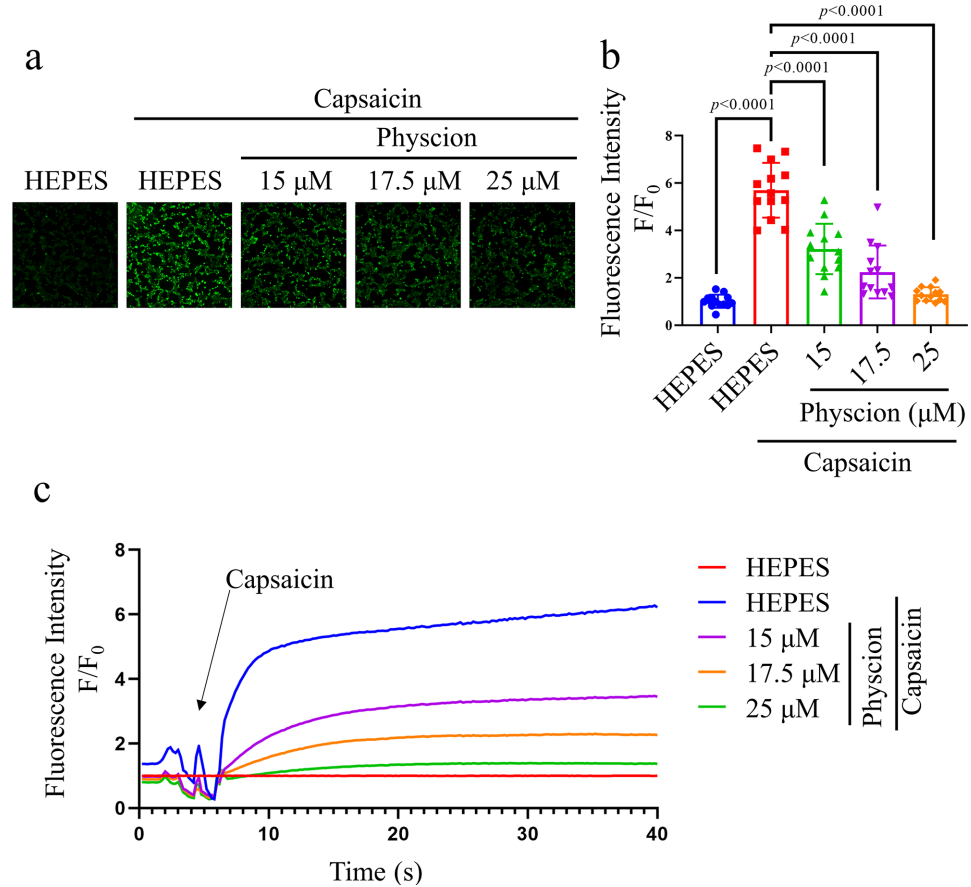
2. 钙成像证实TRPV1功能性抑制
大黄素甲醚(15–25 μM)剂量依赖性抑制HEK293-hTRPV1细胞中辣椒素(1 μM)诱导的Ca2+内流(图4b-c),验证其TRPV1通道阻断活性。
3. 多模型验证体内镇痛功效
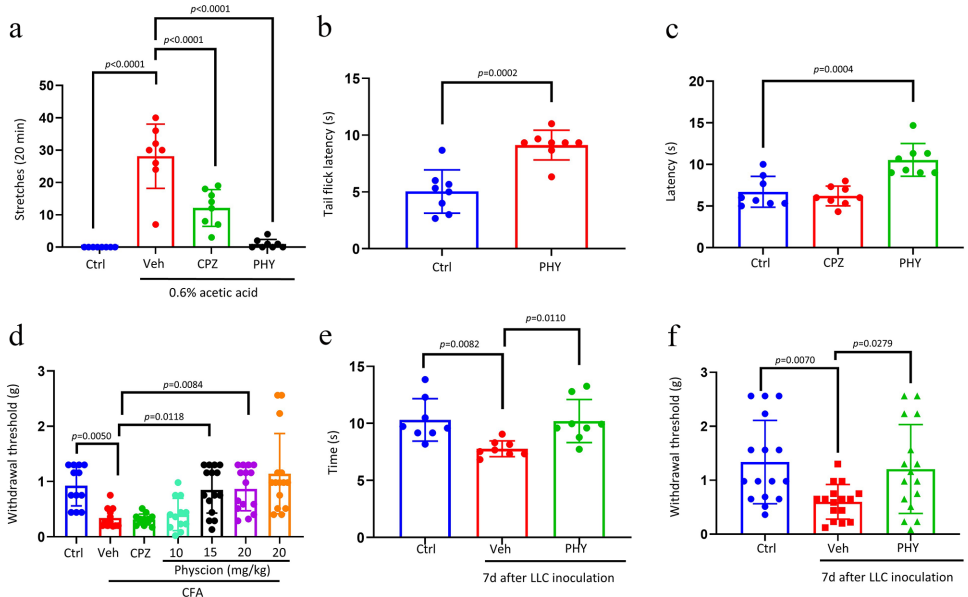
4. 抗炎机制与信号通路调控

 生物通微信公众号
生物通微信公众号
知名企业招聘