
-

生物通官微
陪你抓住生命科技
跳动的脉搏
肝细胞癌铁死亡相关基因标签的多组学分析:预后预测、肿瘤微环境解析及治疗新靶点
【字体: 大 中 小 】 时间:2025年07月12日 来源:Discover Oncology 2.8
编辑推荐:
针对肝细胞癌(HCC)传统治疗疗效有限的问题,上海中医药大学附属上海市中西医结合医院等机构的研究团队通过筛选TCGA-LIHC和ICGC-LIHC数据库中的铁死亡相关基因(FRGs),构建了基于10个核心基因(CAPG、FLT3、G6PD等)的预后模型。该模型风险评分可区分高/低风险患者(AUC=0.991),并揭示高风险组肿瘤微环境(TME)中基质细胞浸润增加、TP53突变富集及对索拉非尼等药物敏感性增强。研究为HCC个体化治疗提供了新型生物标志物和靶向策略。
肝细胞癌(HCC)作为全球高发病率与死亡率的恶性肿瘤,传统治疗手段常因耐药性和复发受限。近年研究发现,铁死亡(Ferroptosis)——一种铁依赖性的程序性细胞死亡方式,通过脂质过氧化和活性氧(ROS)累积触发细胞毒性,在肿瘤发生发展中扮演双重角色:既可抑制肿瘤生长,也可能促进转移。尤其在HCC中,铁代谢与脂质代谢的调控机制尚未明确,亟需挖掘其临床预后价值及治疗靶点。
为突破这一瓶颈,上海中医药大学附属上海市中西医结合医院、海军军医大学附属长征医院的研究团队联合开展了多组学研究。团队整合TCGA-LIHC和ICGC-LIHC数据库的RNA测序及临床数据,结合FerrDb中铁死亡相关基因(FRGs)库,筛选出67个HCC差异表达FRGs。通过LASSO回归和多变量Cox分析,最终锁定10个核心基因(CAPG、FLT3、G6PD、HAVCR1、HMOX1、IL33、MT3、SLC7A11、SRXN1、STMN1),构建预后风险模型。该模型将患者分为高、低风险组,并利用独立队列验证其预测效能。研究成果发表于《Discover Oncology》,为HCC精准诊疗提供了新视角。
数据整合与筛选:从TCGA-LIHC(373例HCC/51例对照)和ICGC-LIHC(243例HCC/202例对照)数据库提取RNA-seq及临床数据,筛选|log2FC|>1且adj.p<0.05的差异表达FRGs。
模型构建与验证:通过LASSO回归和十折交叉验证建立10-FRG预后模型,以风险评分中位数分组,通过时间依赖性ROC曲线(1/3/5年AUC=0.792/0.721/0.717)和KM生存分析验证效能。
多维度机制解析:
肿瘤微环境(TME):基于ESTIMATE算法和TIMER数据库分析免疫/基质评分及免疫细胞浸润。
药物敏感性:利用GDSC和pRRophetic预测化疗药物IC50值,结合GSCA平台评估基因-药物关联。
基因突变图谱:通过cBioPortal分析高频突变基因,采用Oncoplot展示体细胞突变特征。
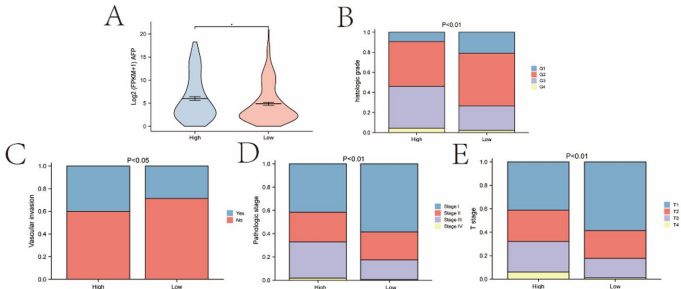
高风险组患者总生存率显著降低(p<0.001),且与临床恶性特征正相关:
AFP水平升高(p<0.05)
组织学分级和病理分期进阶(如III–IV期占比增加)
血管侵袭能力增强(p<0.05)
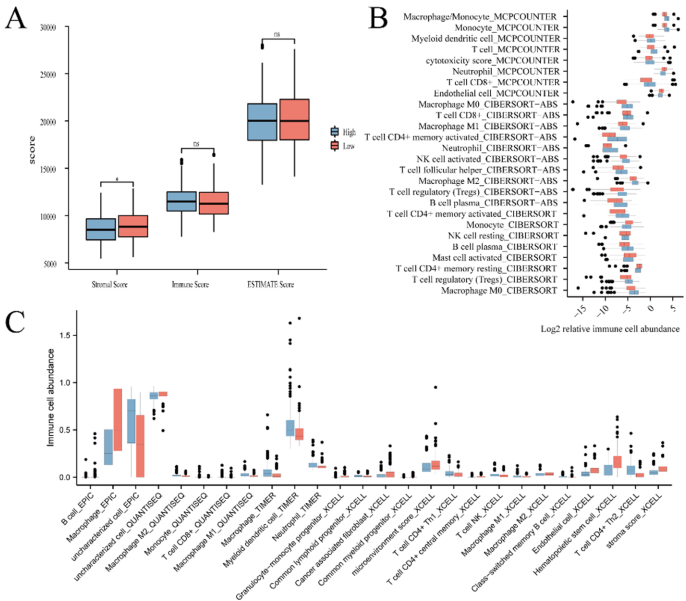
基质评分:高风险组显著升高(p<0.05),提示基质重塑促进肿瘤进展。
免疫浸润:高风险组富集单核细胞、中性粒细胞、巨噬细胞(促炎表型);低风险组以T细胞和髓系树突细胞(抗肿瘤免疫)为主。
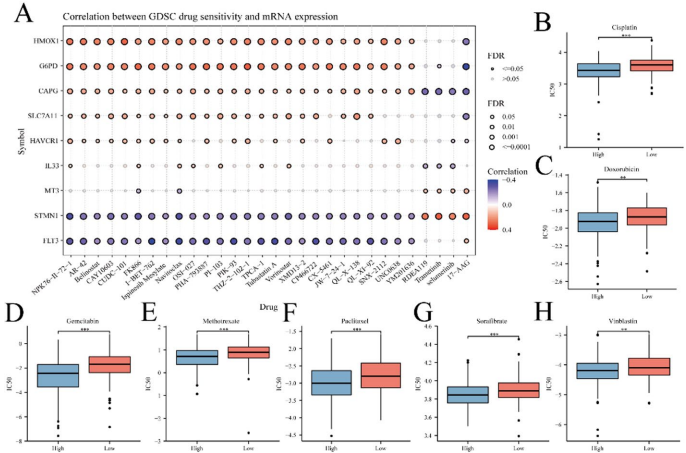
高风险组对7种化疗药物敏感性显著增强:
索拉非尼(Sorafenib,p<0.05)
顺铂/吉西他滨/多柔比星(Cisplatin/Gemcitabine/Doxorubicin)
基因-药物关联分析显示,SLC7A11(调控谷胱甘肽代谢)和STMN1(微管解聚蛋白)分别正向/负向调控药物响应。
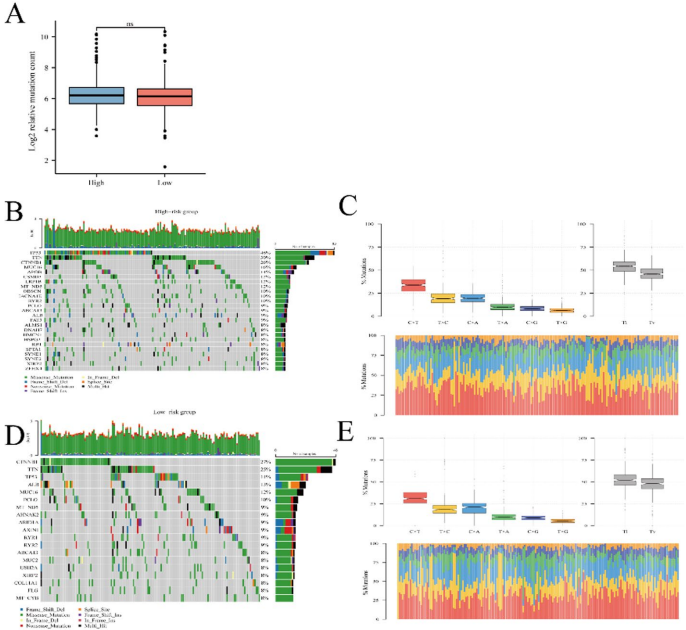
高风险组:TP53突变频率最高(35%),其失活削弱DNA损伤修复,加剧铁死亡失衡。
低风险组:CTNNB1(β-catenin编码基因)突变为主(28%),可能通过Wnt通路抑制肿瘤转移。
本研究首次构建了HCC铁死亡相关10基因预后标签(CAPG/FLT3/G6PD等),其风险评分可精准预测患者生存结局(5年AUC>0.7)。该模型揭示:
临床转化价值:高风险组富集AFP升高、血管侵袭等恶性表型,为高危患者分层提供依据。
微环境调控机制:基质重塑和特异性免疫浸润(如促炎细胞 vs. 细胞毒性T细胞)共同驱动HCC进展。
治疗新策略:高风险组对索拉非尼敏感性增强,且TP53突变提示联合PARP抑制剂可能增效;低风险组CTNNB1突变则暗示Wnt/β-catenin通路靶向治疗潜力。
局限性在于缺乏实验验证FRGs功能机制及多中心队列验证。未来需结合类器官模型和单细胞测序,深入解析铁死亡在TME中的时空动态调控网络,推动HCC个体化靶向治疗发展。
 生物通微信公众号
生物通微信公众号
知名企业招聘