
-

生物通官微
陪你抓住生命科技
跳动的脉搏
MLH1基因框内缺失突变驱动林奇综合征相关结直肠癌的分子机制研究
【字体: 大 中 小 】 时间:2025年07月12日 来源:BMC Cancer 3.4
编辑推荐:
本研究针对林奇综合征(LS)相关结直肠癌(CRC)的遗传机制展开探索,发现MLH1基因新型框内缺失突变(c.1840_1851del)导致Phe614-Lys617氨基酸缺失,通过结构预测和功能实验证实该突变破坏MLH1-PMS2蛋白互作,首次揭示该突变通过影响错配修复(MMR)系统稳定性增加LS致癌风险,为临床VUS变异分类提供重要依据。
在遗传性肿瘤领域,林奇综合征(LS)如同一把悬在患者家族头顶的"达摩克利斯之剑"——这种由DNA错配修复(MMR)基因缺陷引发的常染色体显性遗传病,使得携带者罹患结直肠癌(CRC)的风险飙升80%,更伴随子宫内膜癌等多器官肿瘤威胁。尽管MLH1、MSH2等MMR基因突变已被确认为主要致病因素,但临床实践中仍有大量变异位点被归类为意义未明变异(VUS),犹如"基因密码中的灰色地带",给遗传咨询和早期干预带来巨大挑战。
四川大学华西第二医院妇产科/出生缺陷与相关妇儿疾病教育部重点实验室的研究团队在《BMC Cancer》发表的重要研究,犹如为这片灰色地带投下一束曙光。研究人员通过多组学联合作战,不仅捕获到一个前所未见的MLH1基因框内缺失突变(c.1840_1851delTTTCTGAAGAAG),更运用AlphaFold蛋白质结构预测、免疫共沉淀等"分子侦探工具",成功破解了这个变异导致癌症的分子作案手法——该突变通过删除Phe614-Lys617关键氨基酸,像拆毁桥梁般破坏了MLH1与PMS2蛋白的相互作用,最终导致基因组"纠错系统"全面瘫痪。
研究团队采用四项核心技术展开攻关:首先通过免疫组化(IHC)确认患者肿瘤组织中MLH1/PMS2蛋白表达缺失;继而采用靶向捕获测序(NGS)锁定MLH1基因新型变异;运用AlphaFold预测蛋白质三维结构变化;最后通过体外实验验证突变对MLH1-PMS2复合物稳定性的影响。所有实验均获得四川大学华西第二医院医学伦理委员会批准(2023-120)。
【临床发现】
24岁女性先证者的横结肠癌组织显示典型腺癌特征,H&E染色可见恶性进展标志,免疫组化证实MLH1/PMS2蛋白表达缺失。家系调查发现母亲患子宫内膜癌且携带相同突变,其他亲属存在胃肠道息肉等癌前病变,呈现典型LS家族聚集特征。

【突变鉴定】
NGS检测先证者及其母亲血液样本,均发现MLH1基因第1840-1851位12碱基缺失(c.1840_1851del),导致编码蛋白614-617位氨基酸(p.Phe614_Lys617del)框内缺失。该变异在ClinVar等数据库中未见记载,ACMG分类为VUS。

【结构分析】
AlphaFold预测显示,野生型MLH1中Phe614-Lys617与Tyr610、Glu632等残基形成氢键网络,构成稳定α螺旋结构。突变体该区域螺旋结构坍塌,如同"分子铰链"断裂,导致蛋白质空间构象改变。

【功能验证】
qRT-PCR证实突变不影响MLH1 mRNA表达,但Western blot显示突变体蛋白水平显著降低。Co-IP实验揭示突变使MLH1-PMS2结合能力下降60%,证实该突变通过"多米诺骨牌效应"影响整个MMR复合物稳定性。
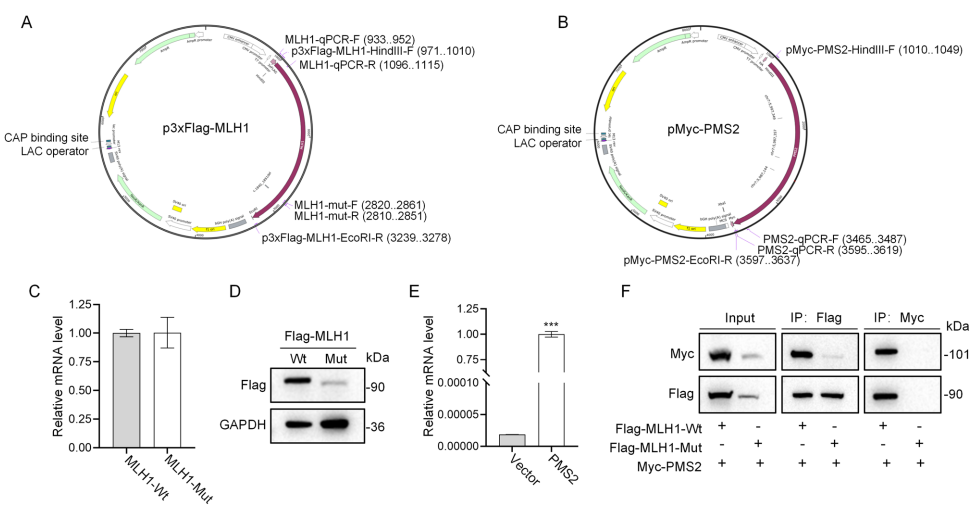
这项研究首次将MLH1基因614-617位氨基酸定义为"分子功能热点",其缺失会像拆除炸弹引信般破坏MMR系统功能。该发现不仅为LS家系提供了明确的遗传诊断标志,更创新性地将AlphaFold结构预测与经典分子生物学技术结合,建立起从基因变异到蛋白质功能缺陷的完整证据链。对于临床遗传咨询而言,研究促使这个原本归类为VUS的变异升级为致病突变,意味着携带此突变的家族成员需要提前10-15年开展肠镜监测,这种"预见性医疗"可能挽救无数生命。未来研究可进一步探索该突变在人群中的携带频率,以及针对此类结构缺陷型突变蛋白的靶向稳定策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘