
-

生物通官微
陪你抓住生命科技
跳动的脉搏
KMT2A::AFF1融合基因驱动CD24+前白血病状态的发育特异性诱导:揭示婴儿急性淋巴细胞白血病(ALL)的胚胎起源
【字体: 大 中 小 】 时间:2025年07月12日 来源:Leukemia 12.8
编辑推荐:
本研究针对婴儿急性淋巴细胞白血病(ALL)中KMT2A::AFF1融合基因的胚胎起源难题,通过新型可诱导小鼠模型,首次揭示了该融合基因在胚胎造血干细胞(HSPCs)中特异性诱导CD24+前白血病B祖细胞群的机制。研究人员发现这一群体具有干细胞特性、谱系可塑性及异常移植能力,其转录特征与人类KMT2A::AFF1白血病高度相关,为靶向CD24和HMGA2的治疗策略提供了理论依据。
婴儿急性淋巴细胞白血病(ALL)中由KMT2A::AFF1(旧称MLL::AF4)融合基因驱动的亚型,是临床预后最差的白血病类型之一,五年生存率仅50%。这类白血病独特之处在于其起源可追溯至胚胎期,但长期以来缺乏能模拟人类疾病早期事件的动物模型。更令人困惑的是,KMT2A::AFF1白血病在婴儿患者中表现出极低的突变负荷和快速进展的特性,暗示其发病机制可能高度依赖发育阶段的特定微环境。这些未解之谜使得阐明该疾病的胚胎起源成为领域内亟待突破的关键科学问题。
瑞典隆德大学(Lund University)干细胞中心的研究团队在《Leukemia》发表的研究中,构建了首个可时空特异性诱导KMT2A::AFF1表达的转基因小鼠模型。通过将人类KMT2A::AFF1融合基因置于Tet-op启动子控制下,并利用Vav-Cre等组织特异性重组酶,实现了在胚胎造血干细胞和祖细胞(HSPCs)中的精准诱导。研究发现,仅在胚胎期诱导该融合基因时,会特异性产生具有CD24+表面标记的前前B细胞(PreProB)群体,这群细胞展现出类似白血病起始细胞的自我更新能力和多谱系分化潜能。单细胞转录组分析进一步揭示,这群细胞的分子特征与人类KMT2A::AFF1白血病患者高度相似,其中HMGA2作为关键调控因子被鉴定为潜在治疗靶点。
研究主要采用四大关键技术:1)条件性诱导转基因小鼠模型的构建(Col1a1-tetO-KMT2A::AFF1与Rosa26-ZtTA系统);2)胚胎和成年小鼠造血干祖细胞的功能分析(包括集落形成实验和移植试验);3)多参数流式细胞术鉴定CD24+ PreProB群体;4)单细胞转录组和表面标记联合测序(CITE-seq)解析分子特征。
KMT2A::AFF1诱导影响胚胎HSPCs的增殖和谱系输出
通过比较胚胎期(E14.5和E18.5)与成年诱导模型,研究发现KMT2A::AFF1对造血干细胞(HSC)的增殖具有选择性抑制,表现为细胞周期G0/G1期阻滞和克隆形成能力下降。这种效应与GATA2表达上调相关,且不受发育阶段影响。但引人注目的是,所有诱导组均表现出显著的髓系分化偏倚,这可能是临床中观察到谱系转换复发的基础机制。
独特的CD24+ PreProB群体在胚胎环境中特异性扩增
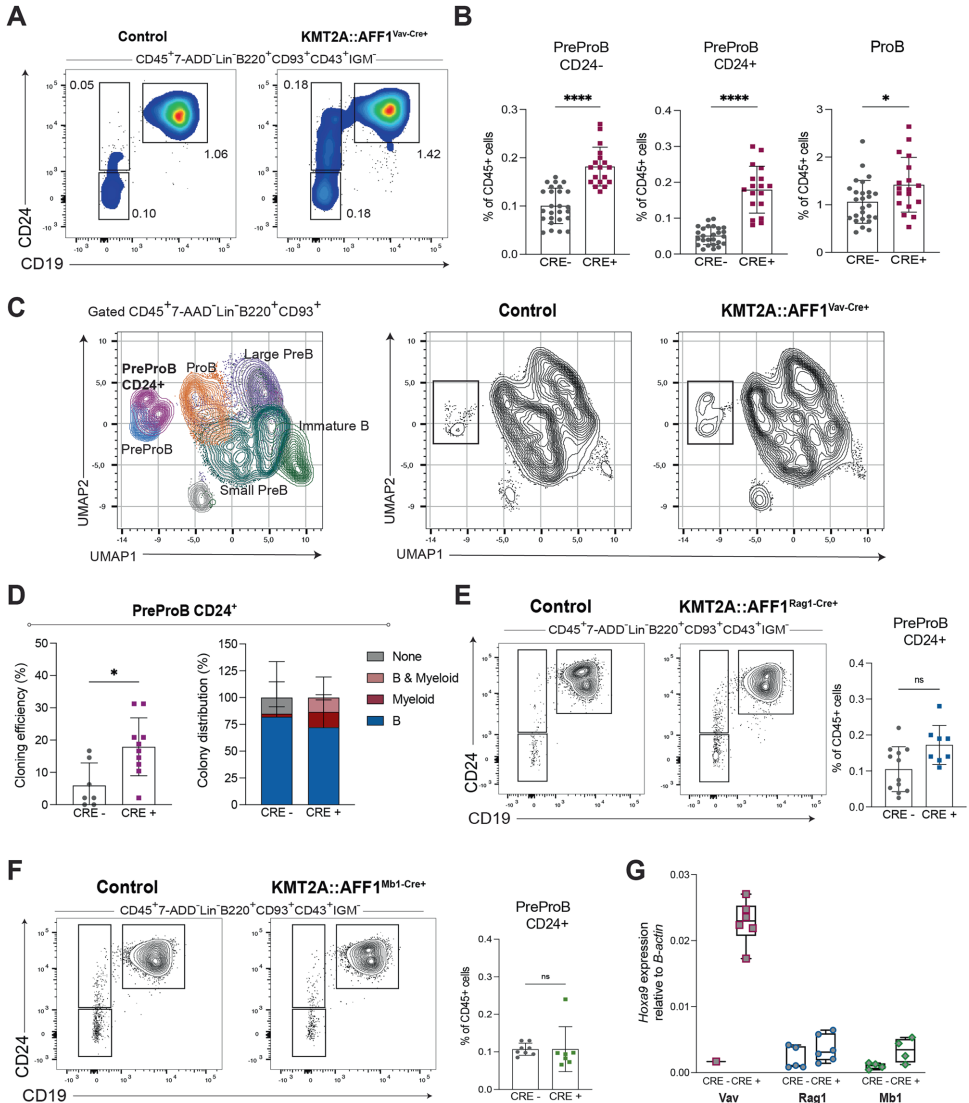
CD24+ PreProB具有前白血病干细胞特性
移植实验显示,仅500-1300个胚胎来源的KMT2A::AFF1+ CD24+ PreProB细胞就能在NSG小鼠中长期重建造血系统,产生B细胞、T细胞和髓系细胞,部分受体还出现脾肿大和分化阻滞等白血病前期表现。单细胞转录组进一步揭示这群细胞高表达HOXA9、MEIS1等KMT2A::AFF1靶基因,以及HLF、MECOM等干细胞相关因子,其分子特征与"长期造血干细胞(LT-HSC)"高度重叠。
分子特征与人类疾病的高度相关性
研究者将小鼠模型中鉴定的48个核心基因特征映射至人类KMT2A::AFF1白血病数据集,发现该特征在患者样本中显著富集,尤其在投射至正常参考图谱中共同淋巴祖细胞(CLP)和前前B细胞位置的blast细胞中。值得注意的是,CD24与HMGA2的共表达模式在胚胎期特异性出现,而HMGA2敲除实验证实其对白血病细胞增殖的关键作用,为靶向治疗提供了依据。
这项研究首次在体内模型中捕捉到KMT2A::AFF1白血病从胚胎起源到前白血病状态的全过程,揭示了发育阶段、细胞起源和分子特征的三重特异性。其临床意义在于:1)阐明CD24+ PreProB作为潜在白血病起始细胞的生物学特性;2)鉴定HMGA2为可干预的分子靶点;3)为开发针对"白血病起源阶段"的拦截策略提供了理论框架。研究者特别指出,CD24作为已进入临床试验的免疫治疗靶点,其在前白血病细胞上的特异性表达为精准干预提供了新思路。该模型未来还可用于测试其他协同突变(如miR-130b/128a)在白血病转化中的作用,推动对这类难治性白血病发病机制的全面认识。
 生物通微信公众号
生物通微信公众号
知名企业招聘