
-

生物通官微
陪你抓住生命科技
跳动的脉搏
EEFSEC基因复合杂合变异导致进行性小脑萎缩的机制研究与临床意义
【字体: 大 中 小 】 时间:2025年07月13日 来源:Journal of Neurodevelopmental Disorders 4.1
编辑推荐:
本研究针对一例4岁女童的全面发育迟缓和进行性小脑萎缩病例,通过全外显子测序技术鉴定出EEFSEC基因的复合杂合变异(p.V488Dfs*113和p.R443P)。研究人员结合功能预测工具与结构分析揭示了p.R443P变异对蛋白稳定性的破坏作用,并通过血浆氧化脂质代谢组学发现患者抗氧化机制受损。该研究首次将EEFSEC基因变异与人类疾病直接关联,为理解硒蛋白合成缺陷相关遗传病的发病机制提供了新视角。
在生命必需的微量元素中,硒以其独特的生物学功能占据重要地位——它通过转化为硒代半胱氨酸(Sec)参与25种硒蛋白的合成,这些蛋白在维持氧化还原平衡、DNA保护和甲状腺激素代谢中发挥核心作用。然而,当硒蛋白合成通路的关键元件发生变异时,可能导致严重的神经系统病变。近期,湖南省妇幼保健院国家卫生健康委出生缺陷研究与预防重点实验室的研究团队在《Journal of Neurodevelopmental Disorders》发表重要成果,揭示了一个令人瞩目的发现:EEFSEC基因变异与进行性小脑萎缩的直接关联。
这项研究源于对一例特殊病例的深入探索。患者是一名4岁女童,表现出全面发育迟缓、构音障碍伴"歌唱样"语言模式,以及持续的高胆固醇血症。最引人注目的是,核磁共振成像显示其小脑半球进行性萎缩。这些临床表现暗示着潜在的代谢异常,促使研究人员对硒蛋白合成通路展开系统性研究。
为阐明病因,研究团队采用多组学技术开展攻关。通过全外显子测序(WES)锁定EEFSEC基因的复合杂合变异,包括父源性的移码变异c.1463_1464del(p.V488Dfs113)和母源性的错义变异c.1328G>C(p.R443P)。结构预测显示,R443P变异导致D3结构域关键氢键网络破坏,而V488Dfs113变异则截断了负责tRNASec结合的D4结构域。功能实验证实,突变体蛋白表达量显著降低,患者血清中硒蛋白SELENOF和谷胱甘肽过氧化物酶(GSH)活性分别降至对照组的42%和21%。更惊人的是,质谱分析发现患者血浆中15-Keto-PGE2、9-HODE等氧化脂质代谢物水平异常升高,最高达对照组的7倍,揭示了抗氧化防御系统的崩溃。
主要技术方法
研究采用全外显子测序鉴定遗传变异,通过AlphaFold2预测蛋白结构变化,建立HA标签表达系统进行Western blot验证,使用ELISA检测血清硒蛋白水平,并运用UHPLC-MS/MS技术定量分析血浆氧化脂肪酸代谢谱。所有实验均以年龄性别匹配的健康儿童作为对照。
神经影像学与遗传学发现
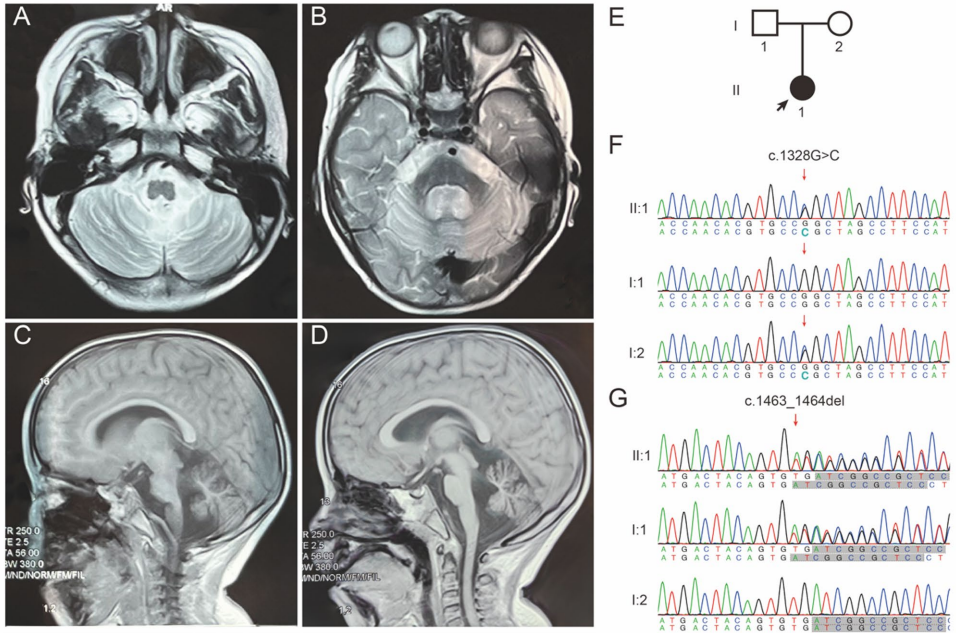
分子机制解析

氧化应激证据
患者血浆中ω-6脂肪酸氧化产物(如9-HpODE)异常积累(表1),而ω-3代谢物(如14-HDHA)显著降低,呈现典型的氧化应激特征。这种脂质过氧化失衡可能是小脑神经元损伤的重要推手。
这项研究首次将EEFSEC基因变异与人类疾病直接关联,拓展了硒蛋白合成缺陷相关疾病的基因谱系。与既往报道的SEPSECS变异病例不同,EEFSEC缺陷患者主要表现为小脑萎缩而非广泛性脑损伤,这为理解硒蛋白的组织特异性功能提供了新线索。更深远的意义在于,该发现为类似临床表现的遗传诊断提供了新靶点,并提示抗氧化治疗可能成为潜在干预策略。正如研究者强调的,这项成果不仅揭示了硒代谢与神经退行性疾病的新联系,也为精准医学时代的罕见病诊疗树立了范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘