
-

生物通官微
陪你抓住生命科技
跳动的脉搏
脊柱曲度衰老的遗传与生理决定因素:基于UK Biobank的多组学解析
【字体: 大 中 小 】 时间:2025年07月14日 来源:Communications Medicine 5.4
编辑推荐:
本研究通过机器学习自动量化UK Biobank中41,212例DXA扫描的胸椎后凸(kyphosis)和腰椎前凸(lordosis)角度,结合GWAS和孟德尔随机化(MR)分析,首次揭示COL11A1、PTHLH等基因通过骨肌稳态和DNA修复通路驱动脊柱曲度衰老,为老年脊柱退行性病变的早期干预提供新靶点。
脊柱曲度衰老的奥秘:从基因到生理的多维度解密
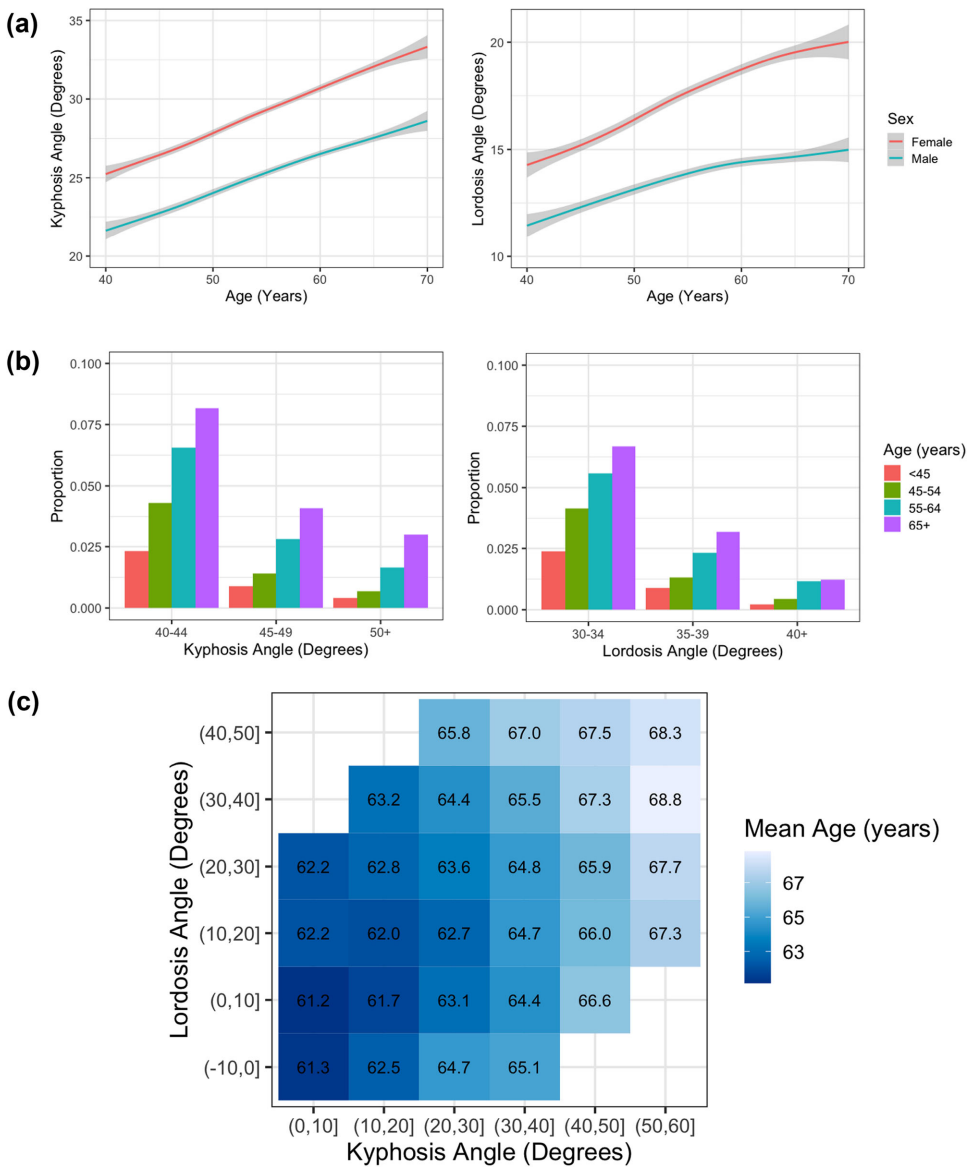
随着年龄增长,脊柱逐渐弯曲已成为人类衰老最直观的标志之一。这种被称为"驼背"的现象,医学上精确区分为胸椎后凸(kyphosis)和腰椎前凸(lordosis)角度增大。尽管全球约15%的75岁以上老人存在病理性脊柱过度弯曲(hyperkyphosis>40°或hyperlordosis>30°),其背后的生物学机制却长期笼罩在迷雾中。传统观点将其简单归因于骨质疏松或椎体骨折,但临床观察发现,许多没有严重骨骼病变的老年人同样会出现进行性脊柱变形。更令人困惑的是,女性脊柱曲度普遍大于男性,而代谢异常患者却表现出矛盾的曲度降低现象。这些未解之谜呼唤着更系统的研究。
为揭开脊柱衰老的复杂面纱,Calico Life Sciences LLC的研究团队开展了一项开创性工作。他们利用英国生物银行(UK Biobank)这一全球最大的人群影像数据库,开发机器学习算法自动测量41,212例双能X线吸收仪(DXA)扫描的脊柱曲度,结合全基因组关联分析(GWAS)和孟德尔随机化(MR)技术,首次绘制出脊柱衰老的遗传-生理全景图谱。论文发表于《Communications Medicine》,揭示了从分子到表型的级联反应如何塑造衰老脊柱的独特形态。
关键技术方法
研究团队建立机器学习流程自动计算Cobb角:①U-net网络分割脊柱区域;②Deming回归确定切线角度。遗传分析纳入33,413例欧洲裔样本,采用REGENIE进行GWAS,通过多性状分析(MTAG)提升统计效能。利用GTEx v8数据库进行共定位和MR分析,验证基因表达的因果效应。生理指标分析涵盖415种疾病、59项血液标志物和15项骨肌参数。
主要研究结果
脊柱曲度的年龄轨迹与性别差异
机器学习模型在测试集表现优异(kyphosis r=0.90,lordosis r=0.89)。数据分析显示,脊柱曲度以每年0.24°(kyphosis)和0.15°(lordosis)的速度递增,女性基线曲度显著高于男性。值得注意的是,75岁以上人群中15.4%存在hyperkyphosis,10.4%存在hyperlordosis,且两者显著共现(OR=5.22)。
疾病与生物标志物的关联图谱
骨质疏松(M81)和椎间盘疾病(M41/M47)与曲度增加最相关,而糖尿病(E11)患者kyphosis反而降低1.5°。血清碱性磷酸酶(ALP)每升高1 SD,kyphosis增加0.47°,而代谢标志物(HbA1c、尿酸)与kyphosis呈负相关。胃食管反流病(GERD)与脊柱曲度的遗传相关性(Rg=0.25)提示共同病理基础。
骨肌系统的双向调控
骨密度(BMD)每降低1 SD,lordosis增加0.54°(p<10-15)。肌肉质量减少与曲度增加显著相关,但脂肪组织呈现区域特异性效应:内脏脂肪增加kyphosis却降低lordosis。梯度提升模型(GBM)显示年龄、肌肉量和内脏脂肪是kyphosis的三大预测因子。
遗传架构与因果基因
GWAS发现8个kyphosis和6个lordosis关联位点,遗传力分别为25-35%。共定位分析锁定COL11A1(胶原蛋白基因)、PTHLH(甲状旁腺激素样分子)和ETFA(线粒体电子转移蛋白)等关键基因。MR证实RAD9A(DNA修复基因)在肌肉中的低表达可导致kyphosis增加(β=0.083,p=3.44×10-8)。
结论与展望
该研究首次系统阐明脊柱曲度衰老的三重机制:①COL11A1等细胞外基质基因维持结缔组织完整性;②RAD9A/MMS22L等DNA修复基因保障细胞稳态;③PTHLH/ETFA调控骨肌代谢平衡。特别重要的是,发现代谢异常通过未知机制"保护性"降低kyphosis,而GERD与脊柱弯曲共享遗传风险,这为开发靶向干预策略开辟了新方向。未来研究可探索PTHLH激动剂或肌肉强化训练是否能够延缓脊柱衰老进程,从而改善老年人活动能力和生活质量。

 生物通微信公众号
生物通微信公众号
知名企业招聘