
-

生物通官微
陪你抓住生命科技
跳动的脉搏
镉暴露致肾毒性的分子机制:基于计算机模拟的miRNA调控网络分析
【字体: 大 中 小 】 时间:2025年07月14日 来源:Scientific Reports 3.8
编辑推荐:
本研究针对氯化镉(CdCl2)诱导肾毒性的分子机制不明问题,通过生物信息学与分子动力学模拟,揭示miRNA(如hsa-miR-146b-5p)通过调控MRPS10等关键基因介导线粒体功能障碍和氧化应激。该研究首次整合AGO-RISC复合物动态相互作用数据,为镉毒性标志物筛选及靶向治疗提供新策略。
镉作为广泛存在的环境污染物,其化合物氯化镉(CdCl2)可通过工业排放和烟草烟雾进入人体,在肾脏近端小管细胞富集并诱发氧化应激与细胞凋亡,最终导致肾功能损伤。尽管镉的肾毒性已被证实,但其分子调控机制尚不明确。近年研究表明,微小RNA(miRNA)在重金属毒性应答中扮演关键角色——这些约22个核苷酸的非编码RNA通过结合靶基因mRNA,介导RNA诱导沉默复合物(RISC)的基因调控功能。然而,镉暴露如何通过miRNA网络精确调控肾细胞毒性通路仍是未解之谜。
为破解这一难题,印度Manipal高等教育学院(Manipal Academy of Higher Education)的研究团队在《Scientific Reports》发表最新研究。他们创新性地结合生物信息学与计算生物学方法,首次绘制了镉暴露下肾小管上皮细胞的miRNA-mRNA调控图谱,并揭示了关键分子MRPS10与hsa-miR-146b-5p的动态相互作用如何驱动肾毒性进程。
研究团队采用四大核心技术:
多维组学数据分析:从GEO数据库获取HK-2细胞镉暴露转录组数据(GSE27211),通过limma包筛选差异表达基因(DEGs),并利用UMAP和PCA进行降维聚类;
互作网络建模:基于STRING数据库构建蛋白互作(PPI)网络,通过CytoHubba鉴定MRPS10等10个核心靶点;
miRNA-mRNA调控解析:整合TargetScan和miRTarBase预测调控核心基因的miRNA,构建包含264节点的调控网络;
分子动态模拟:采用RNAComposer构建miRNA-mRNA双链结构,通过PatchDock将双链与AGO蛋白(PDB 3F73)对接,并运行100 ns分子动力学(MD)模拟验证结合稳定性。
差异表达基因特征
镉暴露12/48小时后,HK-2细胞出现992个显著DEGs(316上调/676下调)。UMAP降维显示暴露组与对照组明显分离,提示时间依赖性转录重编程(见Fig. 1B)。

核心靶点与功能富集
PPI网络拓扑分析鉴定出十大核心基因,其中线粒体核糖体蛋白S10(MRPS10)评分最高。功能富集显示这些基因主要调控:
凋亡负调控(尤其p53通路)
蛋白质代谢与泛素化修饰
锌离子结合与氧化应激响应
(见Fig. 3A-C)

miRNA调控枢纽
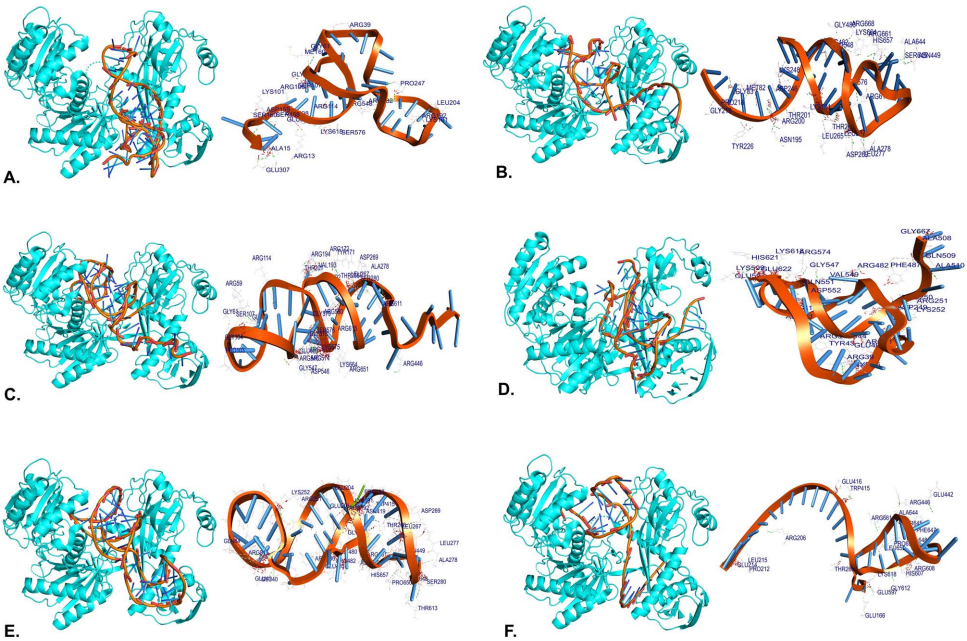
MRPS10受六种miRNA共同调控(hsa-miR-146b-5p, -21-5p, -324-5p, -4257, -4311, -4698)。分子对接显示所有双链均可结合AGO蛋白,其中hsa-miR-146b-5p-MRPS10双链结合能最优(ACE=-140.72),并通过ARG482等残基形成稳定氢键(见Table 4及Fig. 6A)。
分子动力学验证
100 ns模拟表明hsa-miR-146b-5p-MRPS10双链与AGO复合物结构稳定(RMSD=0.398 nm),其3'端位移促进了G11/U39/A40/G41等核苷酸与AGO的氢键网络(平均24个H键),自由能景观(FEL)显示单一能量阱(见Fig. 7-8)。

该研究首次阐明镉肾毒性的miRNA调控轴:暴露通过抑制hsa-miR-146b-5p等miRNA,解除对MRPS10的抑制作用,进而诱发三重病理效应:
线粒体功能障碍:MRPS10下调破坏线粒体蛋白合成,导致能量代谢紊乱;
凋亡逃逸:通过抑制p53通路延缓细胞凋亡,促进DNA损伤累积;
氧化应激恶化:活性氧(ROS)清除能力下降,加速脂质过氧化。
这一发现具有双重价值:
诊断层面:hsa-miR-146b-5p等可作为镉暴露早期肾损伤的生物标志物;
治疗层面:AGO-RISC互作界面(如ARG482残基)为开发抗镉毒性药物提供新靶点。研究创新性地将计算模拟与实验数据整合,为重金属毒性机制研究开辟了跨学科范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘