
-

生物通官微
陪你抓住生命科技
跳动的脉搏
多组学整合分析揭示12种同源小鼠模型中免疫治疗响应的关键分子机制
【字体: 大 中 小 】 时间:2025年07月14日 来源:iScience 4.6
编辑推荐:
本研究针对免疫检查点抑制剂(ICI)疗效预测难题,通过整合转录组、蛋白质组和磷酸化蛋白质组数据,系统评估了DDA与DIA质谱技术的性能差异,首次完成12种同源小鼠模型的深度分子特征解析。研究发现Dnmt3a和Igf2r表达与ICI耐药显著相关,干扰素通路激活是响应组关键特征,并构建了首个交互式多组学分析平台,为肿瘤免疫治疗研究提供重要资源。
肿瘤免疫治疗领域长期面临疗效预测标志物缺乏的挑战,特别是在临床前研究中,传统异种移植模型因免疫缺陷难以模拟人体免疫微环境。虽然同源小鼠模型能保留完整免疫系统,但其分子特征与免疫治疗响应的关联机制尚未系统解析。这导致药物研发过程中难以准确评估候选化合物的免疫调节潜力,也阻碍了生物标志物的发现。
针对这一关键问题,冠科生物技术(苏州)有限公司(Crown Bioscience Inc.)的研究团队在《iScience》发表了突破性研究。该工作首次采用多组学整合策略,对12种常用同源小鼠模型进行深度分子特征解析,不仅建立了技术评估标准,更揭示了免疫治疗响应的核心调控网络,为个性化癌症治疗提供了全新视角。
研究团队主要运用三大关键技术:1) 基于液相色谱-串联质谱(LC-MS/MS)的数据非依赖性采集(DIA)和数据依赖性采集(DDA)蛋白质组学技术对比;2) 整合转录组测序(RNA-seq)、蛋白质组和磷酸化蛋白质组的跨组学分析方法;3) 结合单细胞RNA-seq数据验证的免疫微环境解析技术。所有实验均采用BALB/c和C57BL/6小鼠构建的12种移植瘤模型(包括肝癌H22、黑色素瘤B16F10等),并通过肿瘤生长抑制率(TGI)量化三种免疫检查点抑制剂(抗PD-1、抗PD-L1和抗CTLA4)的疗效。
DIA技术显著提升蛋白质组分析性能
通过系统比较六种定量流程发现,DIA技术在数据覆盖率(缺失值<10% vs DDA的30-40%)、重复性(平均变异系数降低35%)和模型区分度(轮廓系数提高0.2)方面全面优于传统DDA方法。特别值得注意的是,基于计算机模拟库的DIA分析成本效益比最优,为大规模研究提供了可行方案。
免疫微环境特征决定治疗响应

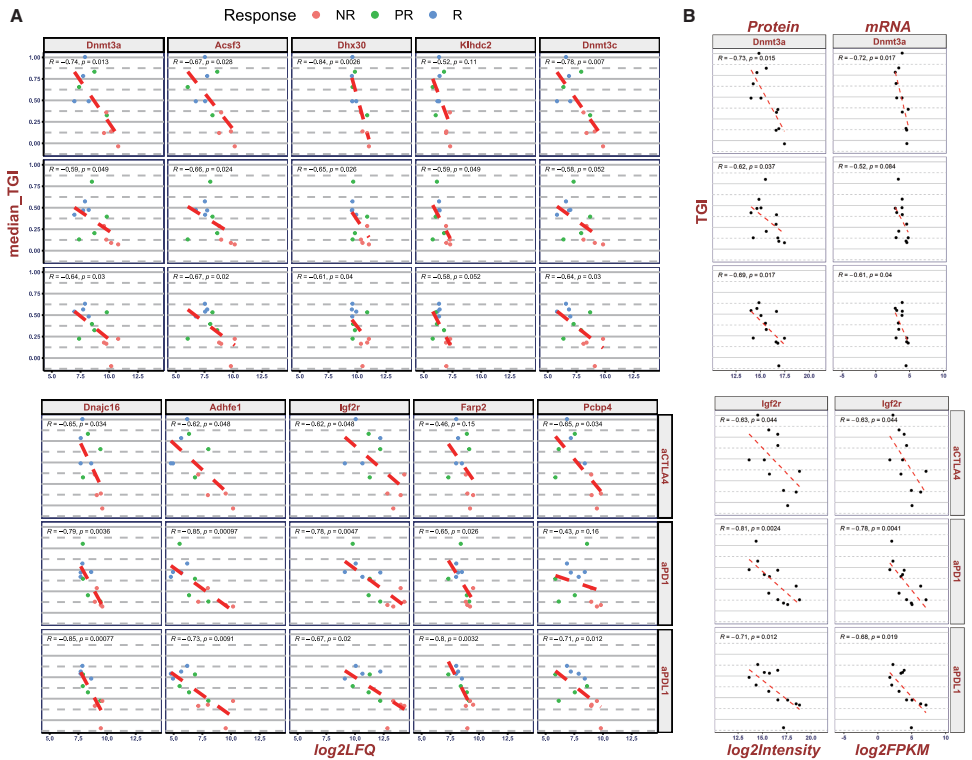
Dnmt3a与Igf2r成为新型耐药标志物
磷酸化网络揭示调控新机制
在鉴定的28,804个磷酸化位点中,响应组呈现更密集的激酶-底物网络(涉及AURKA、PRKDC等),而NR组则表现为代谢相关激酶(如CLK1)的异常活化。特别值得注意的是,Dnmt3a-S386和Igf2r-T1124位点的低磷酸化状态与耐药表型显著相关,提示翻译后修饰在免疫调节中的重要作用。
这项研究通过建立同源小鼠模型的多组学参考图谱,不仅解决了临床前研究中的技术选择难题(证明DIA的优越性),更重要的是发现了Dnmt3a/Igf2r这一对跨模型保守的耐药标志物。研究人员开发的交互式分析平台(https://muscreen.crownbio.com/syngeneic_omics)实现了数据共享与深度挖掘,将加速肿瘤免疫治疗的生物标志物发现。尽管存在模型间微环境异质性的局限,但该研究为理解免疫治疗响应机制提供了分子基础,特别是揭示了表观遗传调控(DNA甲基化)与代谢重编程(氧化磷酸化)的协同作用,为开发联合治疗策略指明了新方向。
 生物通微信公众号
生物通微信公众号
知名企业招聘