
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:糖尿病内皮功能障碍中蛋白质修饰的独特类型
【字体: 大 中 小 】 时间:2025年07月15日 来源:Cardiovascular Diabetology 8.5
编辑推荐:
这篇综述系统阐述了糖尿病(DM)中蛋白质翻译后修饰(PTMs)与内皮功能障碍的关联机制。文章详细解析了糖基化(glycosylation)、泛素化(ubiquitination)、磷酸化(phosphorylation)等12类PTMs如何通过调控线粒体功能、胰岛素分泌等过程影响内皮功能,并探讨了靶向PTMs的药物开发前景,为糖尿病心血管并发症治疗提供了新思路。
糖尿病内皮功能障碍中的蛋白质修饰全景图
糖尿病(DM)是以持续高血糖为特征的代谢紊乱疾病,慢性糖尿病会导致内皮功能障碍,进而引发糖尿病视网膜病变、肾病等多种并发症。近年来,蛋白质翻译后修饰(PTMs)在糖尿病内皮损伤中的作用日益受到关注。本文将深入解析各类PTMs在内皮功能障碍中的调控机制。
蛋白质修饰的多样性及其生物学意义
PTMs是指在蛋白质翻译完成后对其氨基酸残基进行的化学修饰,通过添加或去除特定功能基团实现。目前已知的PTMs超过600种,主要包括:
酰化修饰(乙酰化、乳酸化等)
泛素样蛋白结合(泛素化、SUMO化)
脂质修饰(棕榈酰化等)
氧化还原修饰(谷胱甘肽化等)
特殊化学修饰(糖基化、磷酸化等)
这些修饰能显著影响蛋白质的结构和动力学特性,进而调控其定位、折叠、相互作用和活性,在维持内皮功能中发挥关键作用。
糖基化修饰:糖尿病血管损伤的始动因素
糖基化是最复杂且普遍的PTMs之一,主要包括N-糖基化和O-糖基化两种形式。在糖尿病高血糖环境下,O-GlcNAc糖基化转移酶(OGT)活性增强,导致蛋白质过度糖基化。这种异常修饰会:
抑制胰岛素分泌
促进活性氧(ROS)积累
破坏线粒体功能
晚期糖基化终末产物(AGEs)通过与受体(RAGE)结合,激活NF-κB、MAPK等炎症通路,加剧内皮损伤。研究显示,AGEs能通过GLP-1受体/cAMP/PKA信号通路破坏内皮屏障完整性。
泛素-蛋白酶体系统的失衡
泛素化通过E1-E2-E3酶级联反应调控蛋白质降解。在糖尿病中:
CRL3泛素连接酶功能障碍导致血管收缩增强
肌肉特异性泛素连接酶MG53加重代谢紊乱
HECW2泛素连接酶通过稳定AMOTL1维持内皮连接
泛素特异性蛋白酶10(USP10)可通过激活AMPK通路减轻血管钙化,提示靶向泛素化可能是改善内皮功能的新策略。
磷酸化修饰的信号调控网络
作为研究最深入的PTMs,蛋白质磷酸化在高糖诱导的内皮损伤中发挥多重作用:
GLP-1通过抑制Rho/ROCK通路减少肌球蛋白轻链(MLC)磷酸化
VE-PTP去磷酸化eNOS-Tyr81会降低NO产生
高糖环境下PKM2磷酸化水平升高损害血管舒张功能

乙酰化与代谢记忆
乙酰化修饰通过组蛋白去乙酰化酶(HDAC)和去乙酰化酶(SIRT)的动态平衡调控内皮功能:
线粒体CypD-K166乙酰化导致氧化应激
SIRT6通过去乙酰化Caveolin-1抑制LDL跨内皮转运
HDAC6介导的α-微管蛋白K40乙酰化影响葡萄糖转运
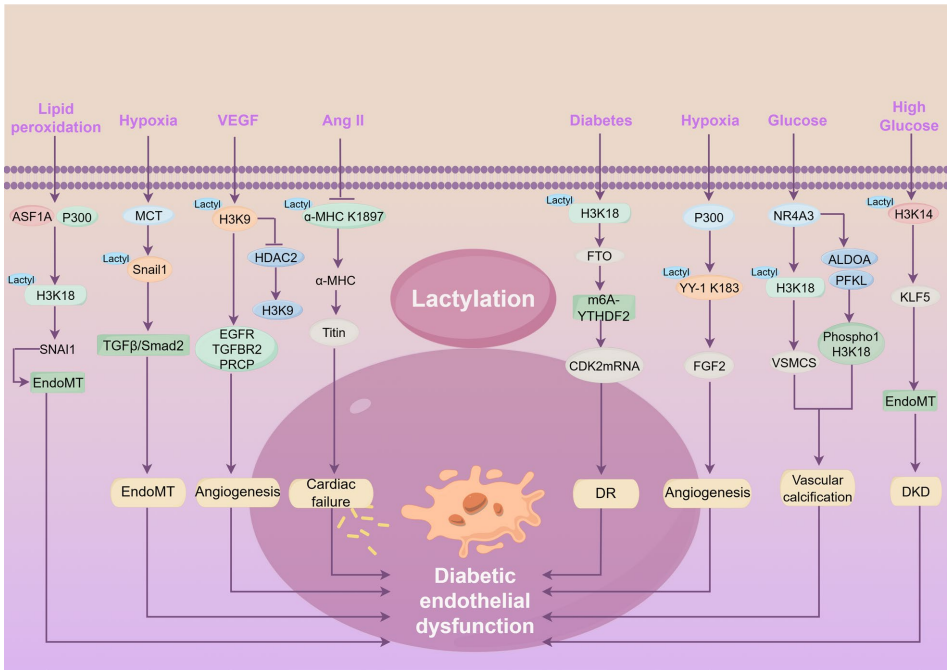
乳酸化:代谢重编程的新维度
乳酸不仅是代谢产物,还能通过组蛋白乳酸化调控基因表达:
H3K18乳酸化激活EndoMT转录因子SNAI1
缺氧诱导的Snail1乳酸化激活TGF-β/Smad2通路
VEGF通过H3K9乳酸化促进血管新生相关基因表达
SUMO化与蛋白质稳态
小泛素相关修饰物(SUMO)通过影响蛋白质定位和活性参与内皮调控:
SENP1介导的VEGFR2去SUMO化异常导致糖尿病血管新生障碍
PPARγ过度SUMO化会抑制eNOS-NO信号通路
SERCA2a的SUMO化改善血管平滑肌收缩功能
其他重要修饰的贡献
甲基化:FTO去甲基化酶调控TNIP1表达影响炎症反应
羰基化:氧化应激导致的蛋白质羰基化加速视网膜病变
S-亚硝基化:eNOS亚硝基化影响NO生物利用度
琥珀酰化:SIRT5介导的OPTN去琥珀酰化保护视网膜内皮
靶向治疗的新机遇
针对不同PTMs开发的药物显示出治疗潜力:
乙酮胺抑制HIF-1乳酸化改善糖尿病心肌病
银杏内酯B通过抑制GPX4泛素化减轻氧化损伤
苯丁酸钠通过抑制HDAC3增强Claudin-5表达
姜黄素类似物通过DNA甲基化改善视网膜病变
未来展望
尽管PTMs研究取得了显著进展,但仍存在诸多挑战:
多种修饰间的交互作用机制尚不明确
动态修饰图谱的构建亟待完善
临床转化证据仍然有限
个体化治疗策略需要进一步探索
通过整合蛋白质组学和代谢组学方法,深入解析PTMs网络将为糖尿病血管并发症的精准治疗开辟新途径。
 生物通微信公众号
生物通微信公众号
知名企业招聘