
-

生物通官微
陪你抓住生命科技
跳动的脉搏
棕色脂肪外泌体miR-206-3p通过抑制磷酸戊糖途径缓解肝脏脂质合成的机制研究
【字体: 大 中 小 】 时间:2025年07月15日 来源:Life Metabolism
编辑推荐:
本研究揭示了棕色脂肪组织(BAT)通过外泌体递送miR-206-3p调控肝脏代谢的新机制。研究人员发现肥胖导致BAT源性外泌体miR-206-3p分泌减少,通过靶向磷酸戊糖途径(PPP)关键酶G6pd和Tkt,影响NADPH生成和脂质合成,为代谢相关脂肪肝病(MAFLD)治疗提供了新靶点。
在全球肥胖流行背景下,代谢相关脂肪肝病(MAFLD)发病率以每年1%的速度增长,却缺乏有效治疗药物。传统观点认为棕色脂肪组织(BAT)主要通过UCP1介导的产热作用改善代谢,但其分泌功能长期被忽视。尤其令人困惑的是,BAT移植在UCP1缺失小鼠中仍能改善糖代谢,暗示存在UCP1非依赖的调控机制。与此同时,临床观察发现肥胖患者血清中外泌体miRNA谱发生显著改变,但这些变化与MAFLD进展的具体关联尚不明确。
复旦大学基础医学院生物化学与分子生物学系的研究团队在《Life Metabolism》发表研究,首次阐明BAT通过外泌体递送miR-206-3p调控肝脏磷酸戊糖途径(PPP)的新机制。研究人员采用多组学方法,发现肥胖导致BAT特异性外泌体miR-206-3p分泌减少,通过靶向G6pd和Tkt抑制PPP通路,进而影响NADPH生成和核苷酸合成,最终改善肝脏脂质沉积和全身代谢紊乱。
关键技术包括:①从肥胖(ob/ob)和野生型小鼠分离BAT源性外泌体进行miRNA测序;②构建脂肪组织特异性miR-206敲除(AKO)小鼠模型;③通过PKH26标记示踪外泌体体内分布;④代谢组学分析肝脏代谢物变化;⑤临床样本验证MAFLD患者血清外泌体miR-206-3p与代谢参数的相关性。
2.1 BAT是外泌体主要来源且肥胖改变其miRNA谱
通过比较三种脂肪组织的分泌能力,发现BAT外泌体分泌量显著高于白色脂肪(iWAT/gWAT)。肥胖小鼠BAT外泌体标志物(Alix/TSG101/CD9)表达降低,miRNA测序鉴定出109个下调miRNA,其中miR-206-3p在三种肥胖模型中均显著下调。
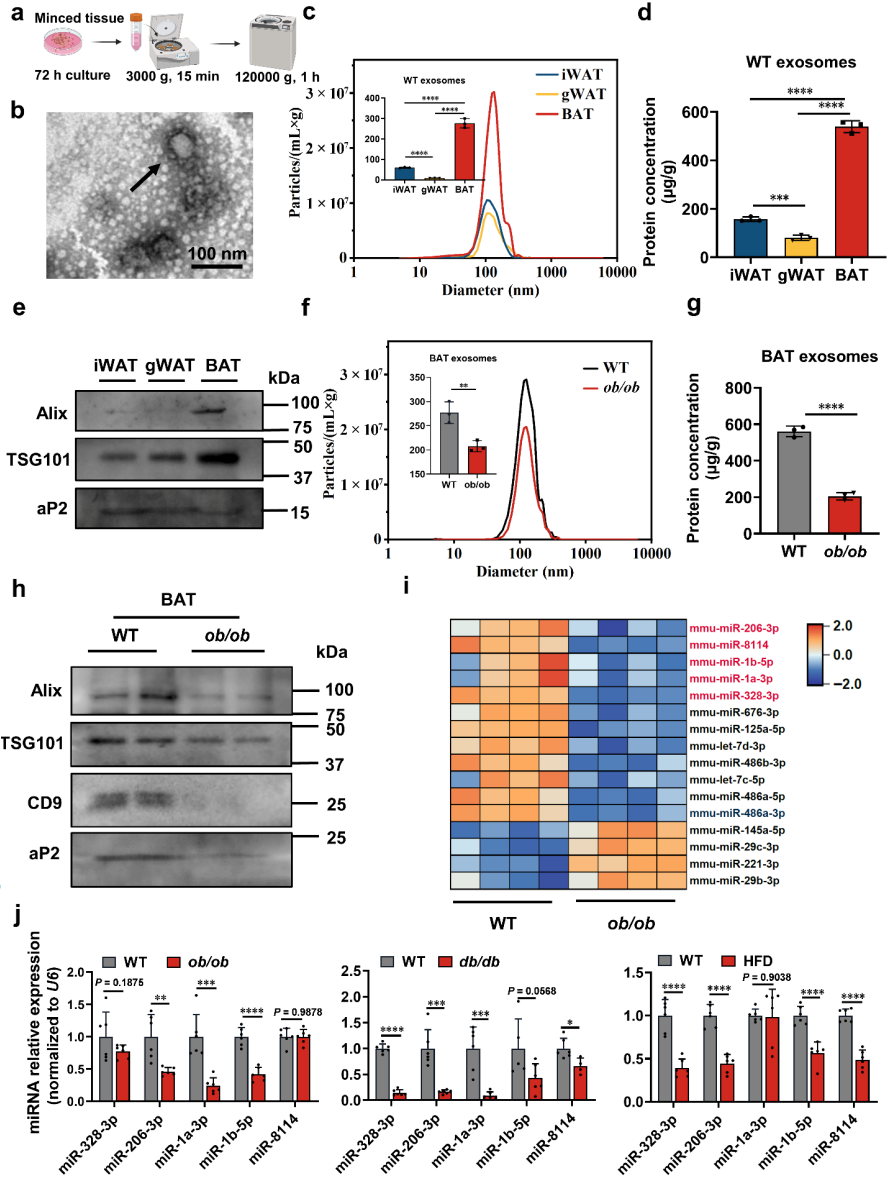
2.2 肥胖抑制BAT中miR-206-3p表达和分泌
miRNAscope显示miR-206-3p在BAT中呈簇状分布,而肌肉中为均匀点状。运动训练特异性地使BAT miR-206-3p表达升高10倍,并增加其在外泌体中的包装效率,提示BAT是循环miR-206-3p的主要来源。
2.3 BAT源性外泌体miR-206-3p递送至肝脏
体内示踪显示BAT外泌体在肝脏富集程度最高。UGUGU外泌体分选基序突变实验证实,该序列对miR-206-3p的特异性包装至关重要。脂肪特异性敲除小鼠(AKO)肝脏miR-206-3p水平显著降低。

2.4 miR-206-3p缺失加剧代谢紊乱
AKO小鼠在高脂饮食(HFD)后出现更严重的葡萄糖不耐受和胰岛素抵抗,能量消耗(VO2/VCO2)显著降低,但BAT产热功能未受影响,表明miR-206-3p主要通过外分泌发挥作用。
2.5 miR-206-3p缺失加重肝脏脂肪变性
AKO小鼠肝脏甘油三酯(TG)含量增加2倍,血清转氨酶(AST/ALT)显著升高。通过BAT局部注射腺病毒过表达miR-206-3p,可逆转HFD诱导的肝脂积累。
2.6 miR-206-3p通过PPP调控肝脏脂质合成
代谢组学显示miR-206-3p过表达使NADPH降低40%,同时增加核苷酸前体(R-5-P/IMP)。荧光素酶报告实验证实miR-206-3p直接靶向G6pd和Tkt的3'-UTR,抑制其表达。
2.7 miR-206-3p是MAFLD相关代谢调节因子
临床样本分析显示MAFLD患者血清外泌体miR-206-3p水平与BMI、LDL呈负相关。肝脏活检显示MAFLD患者PPP酶(G6PD/PGD/TKT)表达显著上调。

这项研究首次阐明BAT通过外泌体miR-206-3p介导的"BAT-肝脏"对话机制:①发现BAT特异性外泌体分选基序UGUGU;②揭示PPP通路在调节肝脂代谢中的核心地位;③提供运动改善代谢的分子解释——通过上调BAT miR-206-3p表达。临床意义在于:血清外泌体miR-206-3p可作为MAFLD诊断标志物,而靶向PPP通路可能成为治疗肥胖相关代谢紊乱的新策略。研究局限性在于需进一步验证外泌体靶向肝脏的具体机制,以及NADPH减少与脂质合成抑制的直接因果关系。
 生物通微信公众号
生物通微信公众号
知名企业招聘