
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于单细胞与空间转录组学的肺腺癌膜蛋白特征谱构建及其在预后预测和精准治疗中的应用研究
【字体: 大 中 小 】 时间:2025年07月16日 来源:Scientific Reports 3.8
编辑推荐:
本研究针对肺腺癌(LUAD)预后标志物匮乏的临床难题,通过整合单细胞RNA测序(scRNA-seq)、空间转录组学和批量RNA测序数据,首次鉴定出35个肿瘤特异性膜蛋白,并构建了9基因膜蛋白预后模型LCaMPS。该模型能准确预测患者5年( AUC=0.644)和10年(AUC=0.684)生存率,揭示其与肿瘤微环境(TME)中中性粒细胞、内皮细胞浸润的显著关联,并预测了66种化疗药物(如吉西他滨、索拉非尼)的敏感性差异,为LUAD的精准诊疗提供了新型分子标志物和用药指导框架。
肺腺癌作为肺癌最主要的亚型,其五年生存率不足20%,临床上面临着预后预测不准、治疗响应个体差异大等严峻挑战。尽管近年来单细胞测序技术揭示了肿瘤异质性,但如何将细胞层面的发现转化为临床可用的标志物仍是难题。尤其值得注意的是,膜蛋白在肿瘤转移和药物响应中扮演关键角色,却鲜有研究系统探索其在肺腺癌中的临床价值。
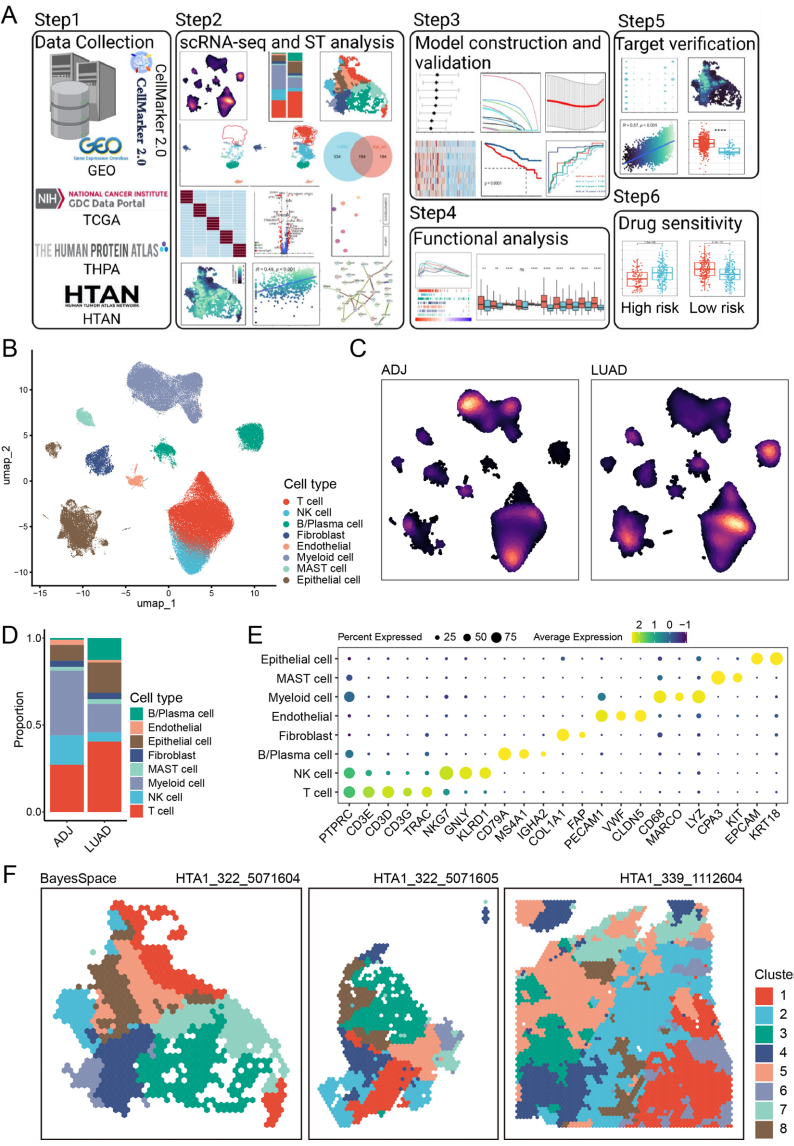
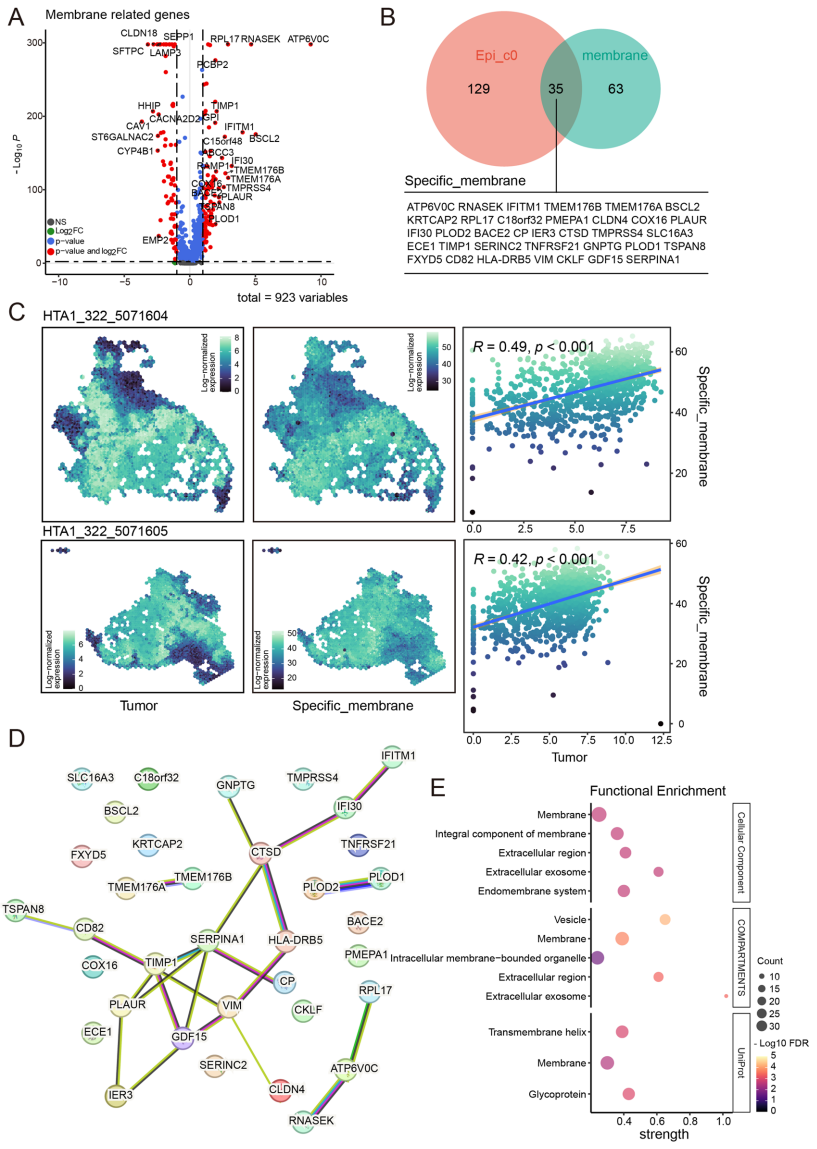
长沙市第一医院胸心外科与华南师范大学脑科学与康复研究院的研究团队在《Scientific Reports》发表的重要研究,通过整合4个scRNA-seq数据集(37样本)、3个空间转录组切片(6,315个点)和TCGA等批量RNA-seq数据,首次构建了肺腺癌膜蛋白特征谱LCaMPS。研究发现表达EMT和缺氧特征的上皮亚群Epi_c0富含35个肿瘤特异性膜蛋白,其中TSPAN8、BACE2等基因与肿瘤区域空间定位显著相关(R>0.45)。基于LASSO回归构建的9基因模型在三个独立队列中均显示优异预测性能,10年生存AUC达0.913。
研究采用多组学整合分析策略:通过Harmony算法整合单细胞数据,利用BayesSpace进行空间聚类;采用ESTIMATE、MCP-counter评估免疫浸润;通过pRRophetic预测138种药物敏感性。关键发现包括:(1)发现Epi_c0上皮亚群高表达TCIM、CCN1等促癌基因,富集p53通路;(2)鉴定出PLOD1-PLOD2等膜蛋白互作网络;(3)LCaMPS高风险组呈现细胞周期、ECM-receptor等通路激活;(4)免疫分析显示高风险组中性粒细胞(p<0.01)、M2巨噬细胞浸润增加;(5)药物预测揭示高风险组对吉西他滨(IC50降低32%)、低风险组对顺铂更敏感。
研究首次在空间维度验证了膜蛋白的肿瘤定位特征,如COX16与肿瘤区域空间相关性达R=0.82。蛋白水平验证显示TSPAN8、SLC16A3等在癌组织显著高表达。值得注意的是,LCaMPS预测的29种敏感药物中包含可靶向NF-κB通路的芹菜素内酯,为克服耐药性提供了新思路。
该研究的突破性在于:①创建了首个整合单细胞与空间信息的膜蛋白预后系统;②发现BACE2等膜蛋白通过糖基化修饰参与TME调控;③临床转化性强,模型可直接应用于现有RNA检测平台。局限性在于尚未开展前瞻性临床试验验证,未来需探索TSPAN8等靶点的功能机制。这项研究为肺腺癌的分子分型和精准治疗提供了全新视角,相关生物标志物有望纳入临床实践指南。

 生物通微信公众号
生物通微信公众号
知名企业招聘