
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:外泌体在免疫病理学中的作用及潜在治疗意义
【字体: 大 中 小 】 时间:2025年07月16日 来源:Cellular & Molecular Immunology 21.8
编辑推荐:
这篇综述系统阐述了外泌体(EVs/exosomes)的生物发生机制、货物分选规律及其在肿瘤、神经系统等八大系统中的免疫病理学作用。文章重点解析了ESCRT依赖/非依赖的外泌体生成途径,揭示了PD-L1+外泌体介导的免疫逃逸机制,并创新性提出通过抑制分泌、阻断摄取、清除病理外泌体等四种干预策略(如GW4869抑制nSMase2、Rab27a敲除等),为疾病治疗提供新视角。
1967年Wolf首次发现血小板释放的"血小板尘埃",1980年代Harding和Pan揭示了网织红细胞分泌小囊泡的机制,Johnstone将其命名为"外泌体"。1996年Raposo发现B细胞外泌体携带MHC-II分子激活T细胞,2007年Lotvall团队突破性证实外泌体可转运mRNA/miRNA,2013年诺贝尔奖授予囊泡运输机制发现者,推动外泌体研究进入黄金时代。
外泌体生成经历精密调控的四阶段:
早期内体形成:Rab5a调控内陷,小窝蛋白-1(caveolin-1)促进膜微区形成,网格蛋白(clathrin)介导内吞。
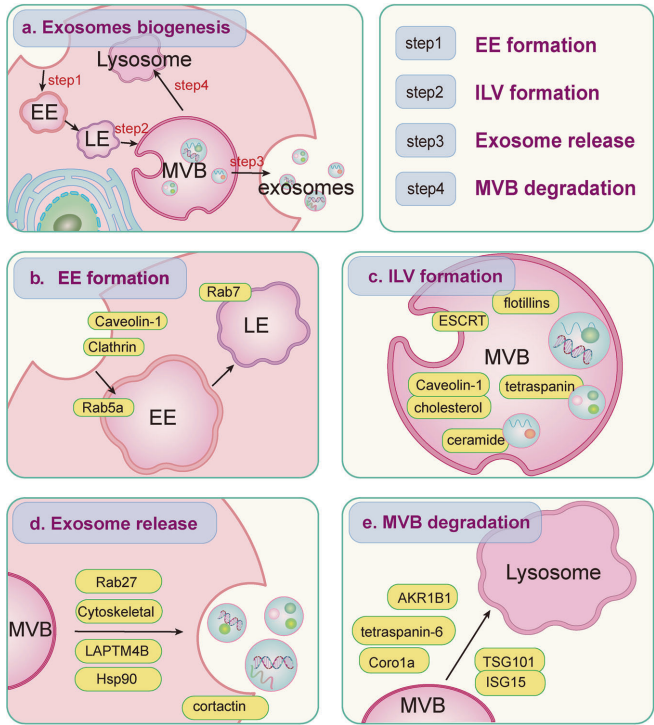
多泡体(MVB)成熟:ESCRT复合物(0-III)识别泛素化蛋白,VPS4水解ATP提供能量;nSMase2将鞘磷脂转化为锥形分子神经酰胺诱导膜弯曲,四跨膜蛋白(CD63/CD9)构建分选平台。
质膜融合释放:Rab27a驱动MVB运输,Rab31-脂筏蛋白Flotillin调控顶端/基底侧不对称分泌,细胞骨架蛋白提供轨道动力。
溶酶体降解分流:nedd化的Coro1a促进Rab7介导的MVB-溶酶体融合,高浓度tetraspanin-6通过syndecan/syntenin复合物引导降解。
外泌体选择性装载蛋白质和RNA:
蛋白分选:ESCRT-0识别泛素化PD-L1,Alix结合LBPA分选四跨膜蛋白,LAMP2A识别KFERQ基序蛋白如HSC70。
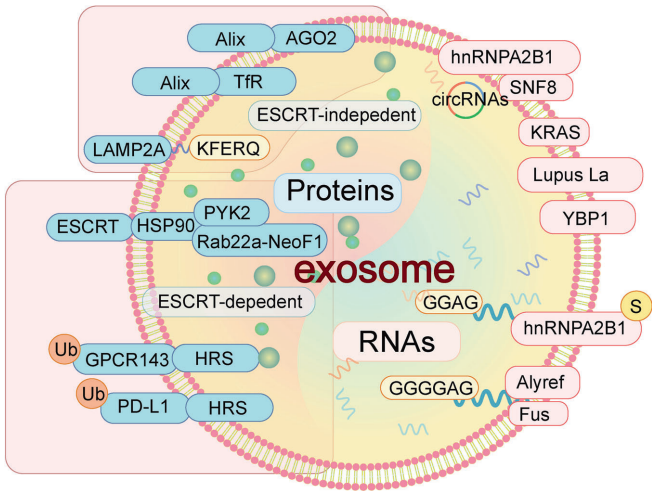
RNA分选:hnRNPA2B1识别GGAG基序miRNA,Alyref结合CGGGAG序列,KRAS通过Ras信号通路调控circRNA分选。肿瘤细胞优先分选miR-21-3p促进肾纤维化,circRHOBTB3则助力结直肠癌肝转移。
外泌体通过同型、异型、跨器官通讯重塑疾病微环境:
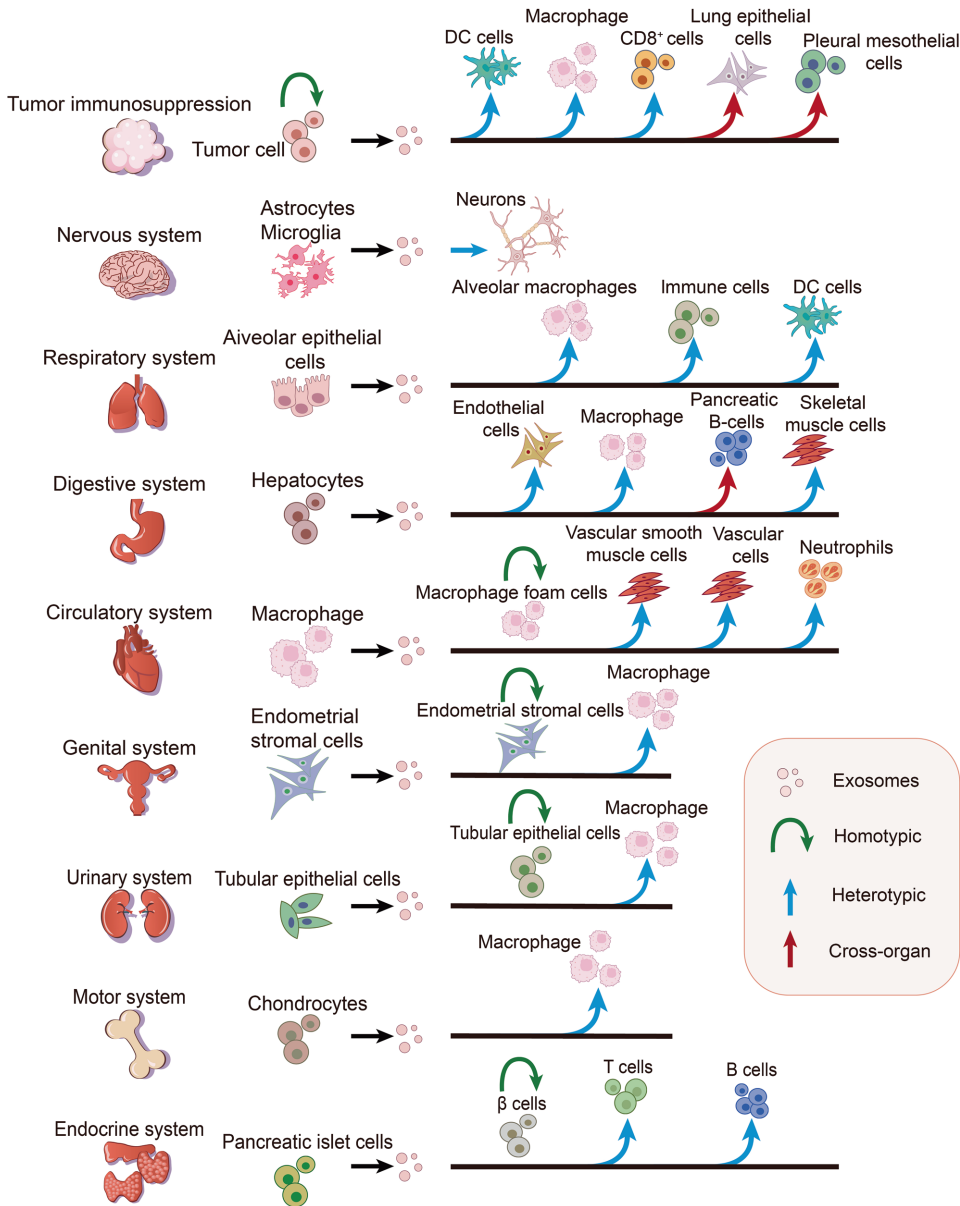
肿瘤免疫博弈:PD-L1+外泌体(TEXs)使CD8+T细胞耗竭,miR-145诱导M2型巨噬细胞极化;而携带肿瘤抗原的外泌体又可激活DC细胞引发抗肿瘤免疫,呈现"双刃剑"特性。
神经炎症风暴:阿尔茨海默病中星形细胞外泌体携带补体损伤神经元,帕金森病中α-突触核蛋白(α-syn)外泌体通过TNFRSF10B诱发神经元凋亡。
代谢紊乱网络:脂肪细胞外泌体miR-34a抑制M2巨噬细胞加剧肥胖炎症,肝细胞外泌体miR-9-5p通过JAK2/STAT3通路激活中性粒细胞N1极化。
源头遏制:GW4869抑制nSMase2,Halopemide阻断PLD2-syndecan通路
阻断摄取:Annexin V中和磷脂酰丝氨酸,抗ICAM-1抗体干扰外泌体-淋巴细胞结合
分选干预:MFGE8中和抗体阻止PD-L1装载,LAMTOR1肽段促进PD-L1溶酶体降解
清除利器:MONOTAB平台靶向降解循环外泌体,血浆置换(TPE)清除65-70%PD-L1+外泌体
外泌体研究仍面临异质性高、追踪技术局限等挑战,但其作为细胞间"分子邮差"的身份,正为疾病诊疗开启全新维度。
 生物通微信公众号
生物通微信公众号
知名企业招聘