
-

生物通官微
陪你抓住生命科技
跳动的脉搏
解锁肿瘤屏障:膜联蛋白A2介导的跨细胞转运增强胰腺癌和乳腺癌的药物递送效率
【字体: 大 中 小 】 时间:2025年07月17日 来源:Nature Communications 14.7
编辑推荐:
本研究针对传统纳米药物递送依赖增强渗透滞留(EPR)效应的局限性,通过开发脂质包被介孔二氧化硅纳米颗粒(LC-MSNP)模型平台,发现膜联蛋白A2(Annexin A2, A2)能显著促进α5β1整合素介导的跨细胞转运,使伊立替康(IRIN)和阿霉素(DOX)在胰腺癌(PDAC)和乳腺癌(BC)模型中的递送效率提升2-6倍。该策略成功拓展至临床批准的多柔比星脂质体,使20%治疗小鼠获得长期生存,为克服基质丰富型肿瘤的递送屏障提供了转化方案。
在肿瘤治疗领域,纳米药物递送长期被"增强渗透滞留效应(EPR)"理论主导——认为纳米颗粒主要通过肿瘤血管的异常渗漏实现富集。然而近年研究发现,在胰腺癌(PDAC)和乳腺癌(BC)等基质丰富的实体瘤中,血管渗漏程度有限,导致基于EPR设计的纳米药物疗效不佳。更棘手的是,目前临床使用的伊立替康脂质体(如Onivyde?)和多柔比星脂质体(如Doxil?)都未针对肿瘤内皮细胞(EC)的生物学特性进行优化,使得这些"老药新装"的纳米制剂在苛刻的肿瘤微环境中举步维艰。
中国科学院国家纳米科学中心的研究团队另辟蹊径,提出"主动转运滞留(ATR)"的新范式,认为跨细胞转运(transcytosis)等主动过程才是纳米颗粒穿越肿瘤血管的关键。他们在《Nature Communications》发表的研究中,开发了脂质包被介孔二氧化硅纳米颗粒(LC-MSNP)作为"纳米探针",通过系统性筛选发现膜联蛋白A2(A2)能特异性激活α5β1整合素介导的跨血管转运。这种"生物导弹"式的递送策略不仅使药物在肿瘤中的富集量提升6倍,更成功让商业化多柔比星脂质体的治疗效果产生质的飞跃——在动物实验中实现了20%的长期生存率。
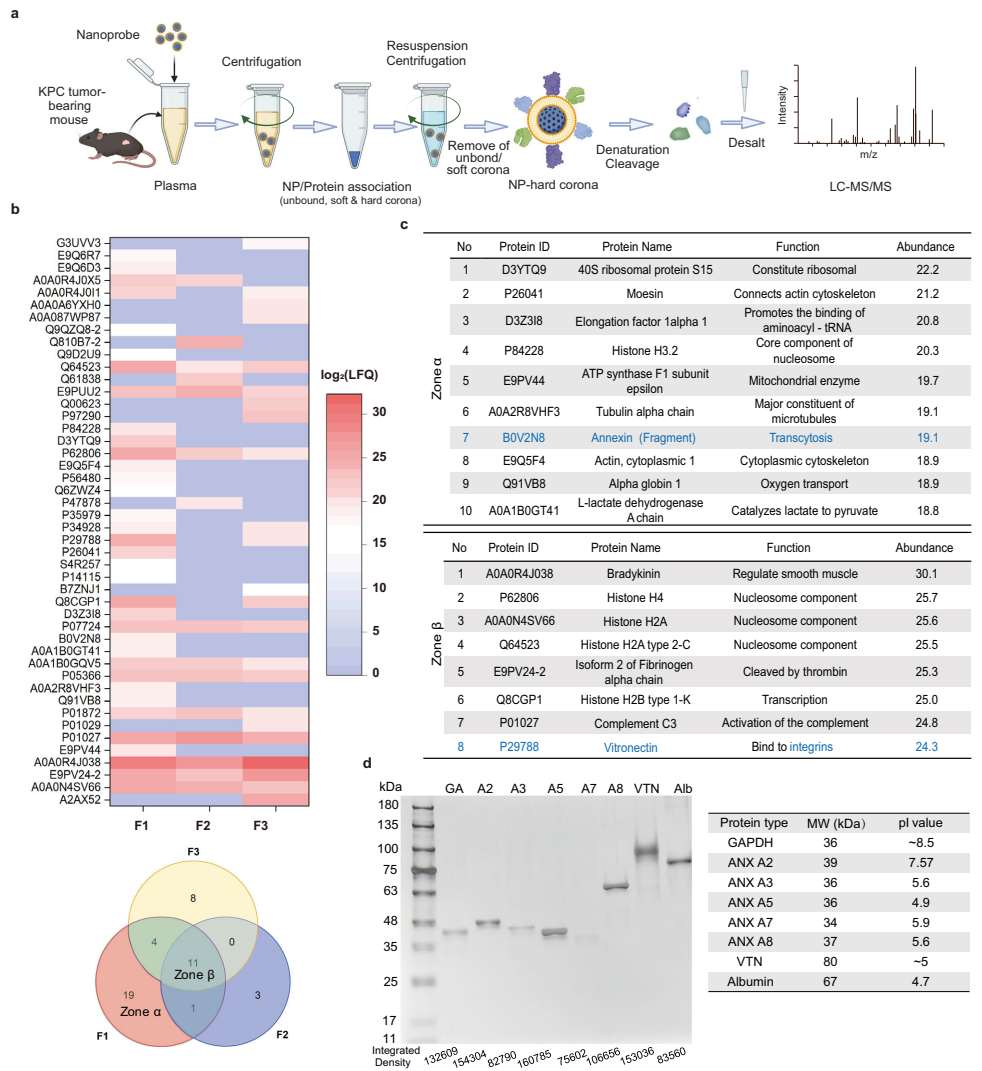
研究团队首先采用电荷工程设计了三种LC-MSNP(F1-F3),通过正交实验锁定中性电荷的F1颗粒具有最佳肿瘤富集能力。质谱分析揭示F1表面特异性吸附的A2蛋白可能介导转运过程,这一假设通过电泳和分子动力学(MD)模拟得到验证——A2通过其α11螺旋的带负电残基(D187/E189等)与脂质膜稳定结合,同时通过疏水面与α5β1整合素相互作用。这种"三明治"式结合模式在"僵尸小鼠"(血管固定模型)和整合素敲低实验中均被证实是跨细胞转运的结构基础。
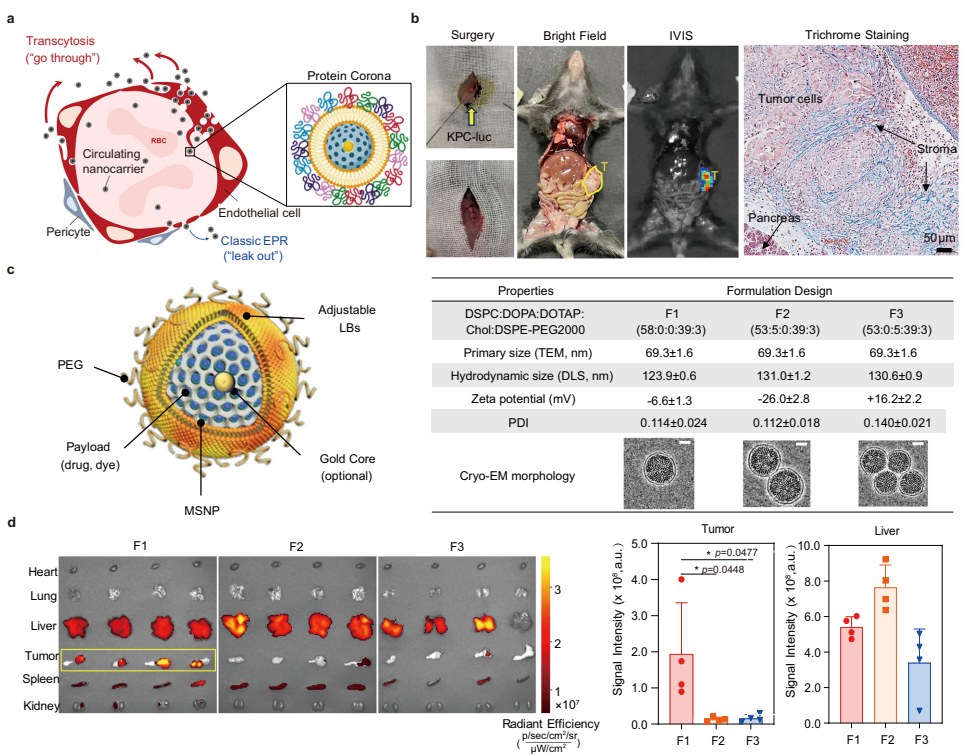
在机制研究部分,透射电镜(TEM)捕捉到金标纳米颗粒穿越内皮细胞的动态过程:1小时内可见颗粒被包裹在囊泡中穿过内皮细胞膜,6小时后已沉积在肿瘤基质中。A2预包被使EMT6乳腺癌模型的纳米颗粒富集量提升6倍,而α5β1整合素表达水平与转运效率呈正相关(R2=0.6456)。这种靶向性在患者来源异种移植(PDX)模型中得到进一步验证——高表达α5β1整合素的BR00164模型对A2修饰制剂的响应显著优于低表达的BR00290模型。
转化医学方面,研究团队创新性地开发了"床边制备"方案:将重组A2蛋白与市售多柔比星脂质体(Duomeisu?)简单孵育1小时即可完成修饰。这种改良制剂在保持原有药代动力学特征(t1/2≈20h)的同时,使EMT6模型小鼠的肿瘤抑制率显著提升(p=0.0014),更令人振奋的是,治疗组中有两只小鼠获得超过80天的长期生存。
这项研究的意义在于:首先,提出"膜联蛋白-整合素"轴是调控纳米药物跨血管转运的关键开关,为克服肿瘤递送屏障提供了新靶点;其次,开发的A2预包被技术具有"即插即用"特性,可直接提升现有纳米药物的疗效;最后,发现α5β1整合素表达水平可作为预测标志物,为精准纳米医学奠定基础。该成果不仅刷新了对纳米药物递送机制的认识,更为临床转化提供了切实可行的技术路径——通过简单的蛋白修饰,就能让"老药"焕发"新生"。
 生物通微信公众号
生物通微信公众号
知名企业招聘