
-

生物通官微
陪你抓住生命科技
跳动的脉搏
脑小血管病与内侧颞叶蛋白病变的关联机制及其在阿尔茨海默病中的病理意义
【字体: 大 中 小 】 时间:2025年07月17日 来源:Acta Neuropathologica Communications 6.2
编辑推荐:
本研究针对脑小血管病(CSVD)与阿尔茨海默病(AD)相关蛋白病变在内侧颞叶(MTL)区域的相互作用机制展开深入探索。研究人员通过深度学习算法定量分析152例尸检样本,首次揭示脑淀粉样血管病(CAA)严重程度与β淀粉样蛋白(Aβ)斑块和tau神经原纤维缠结密度呈正相关,而动脉硬化则通过影响血管周围间隙(PVS)扩大参与清除功能障碍。该研究为理解血管因素在AD病理进程中的作用提供了重要证据,发表于《Acta Neuropathologica Communications》。
在探索阿尔茨海默病复杂病因的过程中,脑小血管病变与蛋白异常沉积的相互关系始终是科学界关注的焦点。内侧颞叶作为记忆形成的关键脑区,既是AD病理最早累及的区域,也是脑小血管病好发部位。然而,这两种病理变化是简单共存还是存在因果关联?血管异常是否会通过影响蛋白清除加速神经退行性病变?这些问题对于理解AD发病机制和开发新型治疗策略具有重要意义。
为解答这些关键问题,美国哈佛医学院麻省总医院(Massachusetts General Hospital, Harvard Medical School)J. Philip Kistler卒中研究中心的Valentina Perosa团队开展了一项创新性研究。研究人员通过对152例尸检样本的系统分析,首次在内侧颞叶区域实现了脑小血管病与AD相关蛋白病变的精准定量关联研究,相关成果发表在神经病理学权威期刊《Acta Neuropathologica Communications》。
研究团队运用多项关键技术:1)基于Aiforia平台的卷积神经网络(CNN)实现Aβ斑块、CAA、tau缠结和pTDP-43包涵体的自动定量;2)半自动化的血管周围间隙(PVS)面积测量技术;3)线性混合效应模型(LME)进行多因素统计分析。样本来自麻省阿尔茨海默病研究中心(MADRC)尸检队列,涵盖从Braak 0期到VI期的完整疾病谱系。
CAA负担随Braak分期递增
深度学习定量分析显示,在所有内侧颞叶亚区(海马、后海马旁皮质、杏仁核和嗅皮质),CAA面积百分比随Braak分期显著增加(p<0.001)。这一发现提示血管Aβ沉积与AD神经病理变化存在协同进展关系。
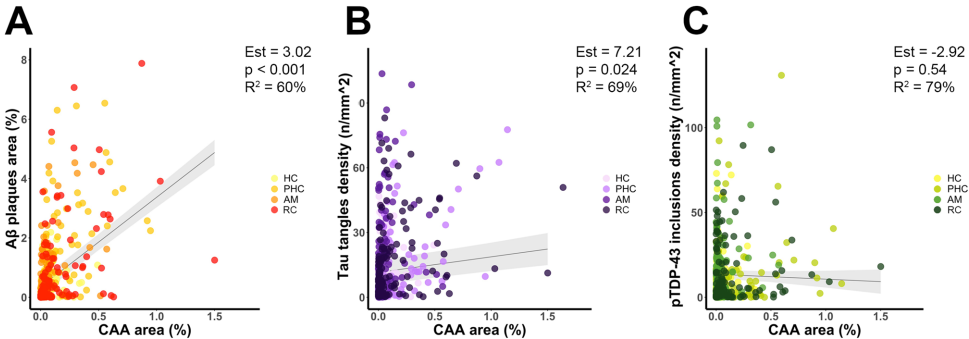
CAA与蛋白病变的定量关联
线性混合效应模型揭示,CAA面积与Aβ斑块百分比面积呈强正相关(Est.=3.02,p<0.001),与tau缠结密度也显著相关(Est.=7.21,p=0.024)。这种关联独立于Braak分期存在,在嗅皮质和后海马旁皮质尤为显著。
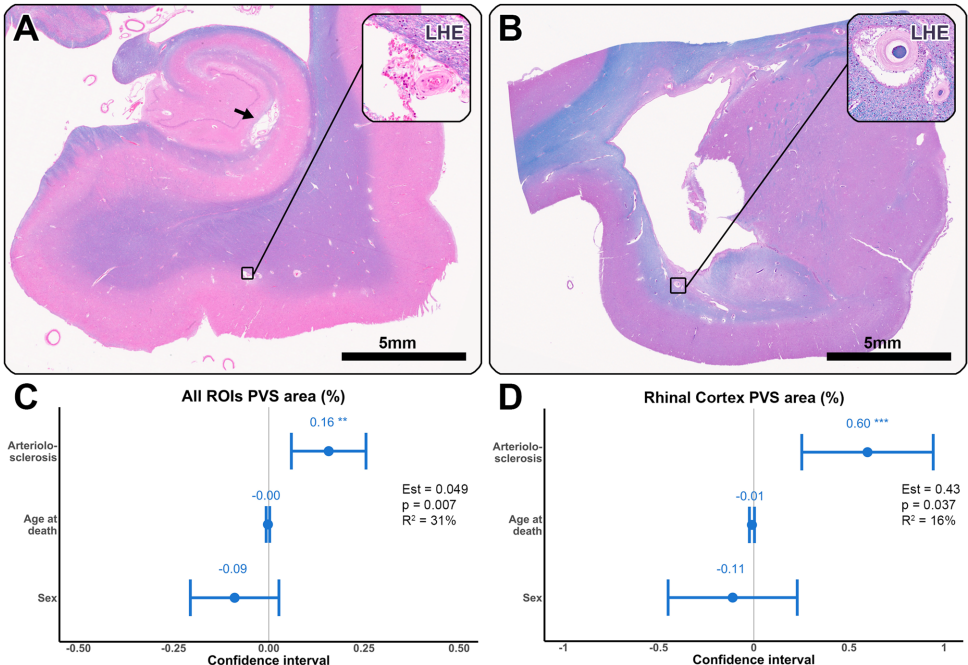
动脉硬化与PVS扩大的新发现
虽然动脉硬化严重程度与蛋白病变无直接关联,但研究发现中度/重度动脉硬化与PVS面积扩大显著相关(Est.=0.16,p=0.002)。更值得注意的是,动脉硬化与CAA的交互作用对PVS扩大具有协同效应(p=0.003),提示两种血管病变可能共同损害血管周围清除功能。
pTDP-43的独特性
与其他蛋白病变不同,pTDP-43包涵体密度与CAA或动脉硬化均无显著关联,表明TDP-43蛋白病变可能遵循独立于血管病理的发病机制。
这项研究通过创新的定量病理学方法,首次系统阐明了内侧颞叶区域脑小血管病与AD相关蛋白病变的复杂相互作用。主要突破体现在三个方面:
首先,证实CAA不仅是AD的伴随现象,更可能通过血管周围清除功能障碍参与Aβ和tau病理的恶性循环。这为理解AD中血管与神经退行性病变的协同作用提供了直接证据。
其次,发现动脉硬化虽不直接影响蛋白沉积,但通过与CAA的协同作用促进PVS扩大,这为"清除功能障碍假说"提供了重要支持。PVS扩大可能成为评估血管性认知障碍的新型生物标志物。
最后,研究建立的深度学习定量分析方法(包括CAA面积百分比、tau缠结密度等指标)为神经病理学研究提供了可推广的技术框架。这种客观定量方法克服了传统半定量评分的局限性,特别适合多中心研究的数据整合。
该研究的临床意义在于提示针对脑小血管病的干预措施(如血压管理)可能通过改善血管周围清除功能延缓AD进展。未来研究可进一步探索APOE基因型对这些关联的调节作用,并在更大规模的社区队列中验证发现。
值得注意的是,研究也存在一定局限性,如横断面设计难以确定因果关系,且未能评估Lewy小体等其他共病病理的影响。这些问题为后续研究指明了方向,包括开展纵向病理队列研究和开发更完善的动脉硬化定量方法。
 生物通微信公众号
生物通微信公众号
知名企业招聘