
-

生物通官微
陪你抓住生命科技
跳动的脉搏
同步分析蛋白质磷酸化与S-亚硝基化的新型蛋白质组学工作流程揭示植物信号转导新机制
【字体: 大 中 小 】 时间:2025年07月17日 来源:aBIOTECH 4.6
编辑推荐:
针对蛋白质翻译后修饰(PTM)交叉调控研究的技术瓶颈,广东农业科学院团队开发出磷酸亲和标签转换(PAT-switch)技术,首次实现磷酸化与S-亚硝基化的同步富集检测。在拟南芥幼苗中鉴定到12,552个磷酸化位点和6,108个S-亚硝基化位点,发现968种双修饰蛋白参与光合作用与代谢调控,为植物PTM交叉调控研究提供突破性工具。成果发表于《aBIOTECH》。
在生命活动的精密调控网络中,蛋白质翻译后修饰(Post-translational modifications, PTMs)如同分子世界的"密码",通过动态改变蛋白质功能来调控细胞活动。其中,磷酸化(phosphorylation)和S-亚硝基化(S-nitrosylation)是两种备受关注的重要修饰——前者通过添加磷酸基团调控蛋白质活性,后者通过一氧化氮(NO)与半胱氨酸结合影响蛋白质功能。尽管已有证据表明这两种PTM存在交叉调控(crosstalk),但由于它们化学性质差异大,传统技术需要分别进行富集检测,不仅样本消耗量大,还存在重复性差、操作复杂等问题,严重阻碍了对PTM协同调控机制的深入探索。
针对这一技术瓶颈,广东省农业科学院农业生物基因研究中心的研究团队创新性地开发出磷酸亲和标签转换(Phosphate Affinity Tag-switch, PAT-switch)技术。这项发表于《aBIOTECH》的研究,通过将S-亚硝基化位点转化为"伪磷酸化"位点,首次实现两种PTM的同步富集和分析。研究人员采用三步反应流程:先用碘乙酰胺(IAA)封闭游离巯基,再用含磷酸基团的标签(6C-CysPAT)特异性标记S-亚硝基化位点,最后通过 immobilized metal ion affinity chromatography (IMAC) 同步富集磷酸化肽段和PAT标记肽段。借助高精度质谱技术,成功在拟南芥(Arabidopsis thaliana)幼苗中绘制出迄今最全面的PTM图谱。
关键技术包括:(1)优化PAT标记条件(5 mM浓度,60分钟反应);(2)建立自动化在线富集系统减少样本损失;(3)采用高pH反相液相色谱(high-pH RP-HPLC)分级降低样本复杂度;(4)开发双修饰数据分析流程。实验使用30 mg拟南芥幼苗样本,较传统方法降低90%样本需求。
研究结果揭示:
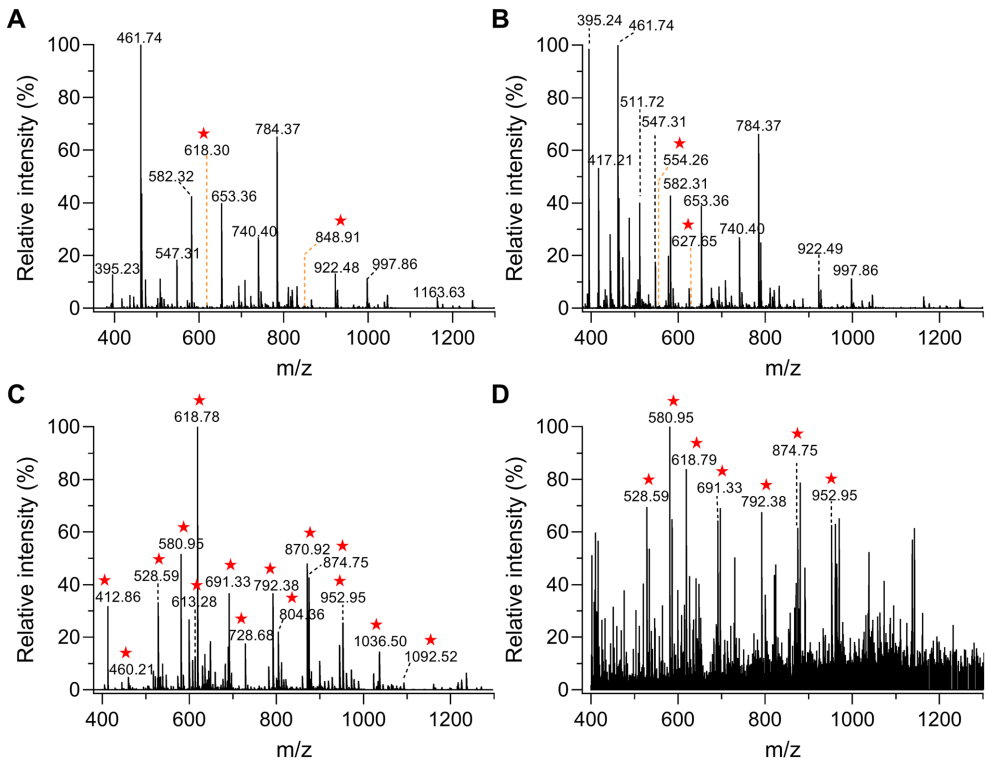
方法学验证:在模型蛋白SNO-BSA测试中,PAT-switch/IMAC方法成功富集到30个S-亚硝基化位点(占BSA总半胱氨酸数的85.7%),灵敏度达100 fmol(图2)。比较实验显示,该方法S-亚硝基化检测覆盖度与专用技术FAT相当,磷酸化检测与GreenPhos接近(图3)。
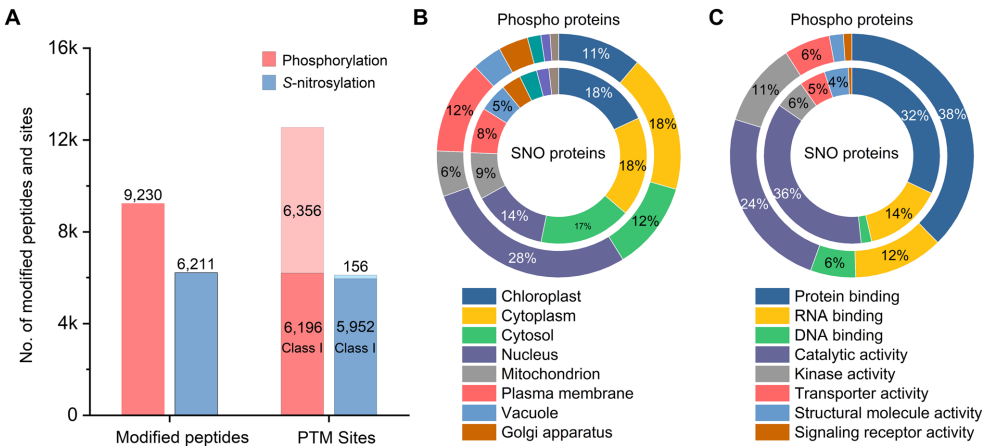
全局PTM图谱:共鉴定12,552个磷酸化位点(6,196个Class I位点)和6,108个S-亚硝基化位点(5,952个Class I位点),其中3,795个S-亚硝基化位点为首次报道(图4)。双修饰蛋白在叶绿体和代谢通路中显著富集,包括碳固定(carbon fixation)和糖酵解(glycolysis)相关酶类(图5)。
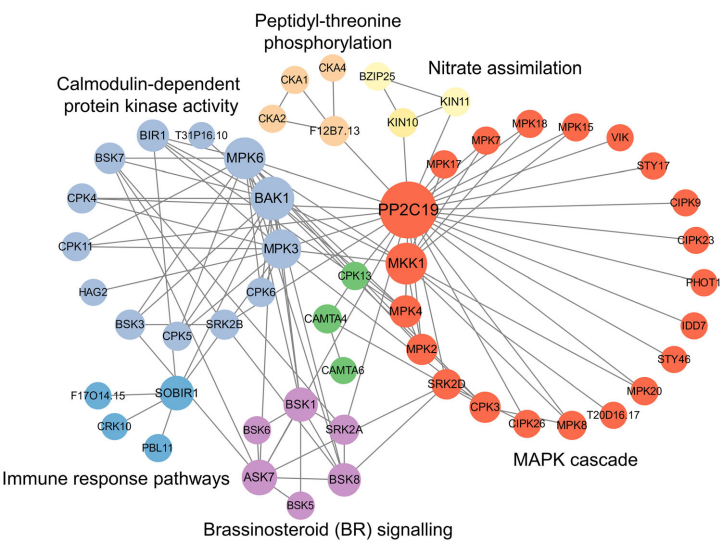
关键调控蛋白:发现56种激酶(如SnRK2.3、MAPK家族)和17种转录因子存在双修饰,蛋白互作网络分析揭示这些蛋白形成以PP2C19为中心的调控枢纽,参与BR信号(brassinosteroid signaling)和免疫应答等通路(图6)。
这项研究建立的PAT-switch技术突破了多PTM同步分析的技术壁垒,其创新性体现在:(1)通过化学标签转换实现异质PTM的统一富集;(2)将S-亚硝基化检测灵敏度提升至fmol级;(3)首次系统揭示植物中磷酸化与S-亚硝基化的交叉调控网络。发现的968种双修饰蛋白为研究植物逆境响应、代谢调控和发育过程提供了新靶点,特别是TOR激酶Cys-49等新位点的发现,为阐明PTM级联调控机制开辟了新途径。该技术方案具有普适性,可拓展至其他PTM研究领域,为复杂生命过程的解码提供强大工具。
 生物通微信公众号
生物通微信公众号
知名企业招聘