
-

生物通官微
陪你抓住生命科技
跳动的脉搏
锰通过调控氧化应激和网络药理学关键靶点缓解阿特拉津诱导的肝肾毒性
【字体: 大 中 小 】 时间:2025年07月17日 来源:BMC Pharmacology and Toxicology 2.8
编辑推荐:
本研究针对广泛使用的除草剂阿特拉津(ATZ)引发的肝肾毒性问题,通过整合网络药理学和体内实验,揭示了锰(Mn)通过调控STAT3/PPARG/GSK3B等关键靶点及氧化应激通路发挥保护作用的分子机制。研究人员发现10 mg/kg Mn可显著改善ATZ导致的SOD、CAT等抗氧化酶活性下降,降低XOD/H2O2/RONS等氧化应激标志物,并缓解肝细胞坏死和肾小管损伤。该研究为环境毒素防治提供了新的干预策略。
在农业生产中广泛使用的三嗪类除草剂阿特拉津(Atrazine, ATZ),因其在环境中的持久性和生物蓄积性,已成为全球性的健康隐患。尽管欧盟已禁止使用,监测数据显示其在水体和食品中的残留仍普遍超标。这种化合物通过细胞色素P450酶代谢产生的毒性中间体,会引发线粒体功能障碍和氧化应激,导致肝肾功能损伤。更令人担忧的是,现有研究对ATZ毒性缺乏系统性的机制解析,也缺乏有效的干预手段。
针对这一科学难题,尼日利亚伊巴丹大学(University of Ibadan)癌症研究与分子生物学实验室的Solomon E. Owumi团队创新性地将网络毒理学与动物实验相结合,探索了必需微量元素锰(Manganese, Mn)的解毒潜力。这项发表在《BMC Pharmacology and Toxicology》的研究,首次揭示了Mn通过多靶点调控网络缓解ATZ毒性的分子机制。
研究人员主要采用四大技术方法:1) 网络药理学预测ATZ毒性靶点与Mn保护靶点的交集基因;2) 大鼠28天染毒实验(ATZ 10 mg/kg联合Mn 2.5/10 mg/kg);3) 肝肾功能指标(ALT/AST/尿素等)和氧化应激标志物(SOD/CAT/MDA等)检测;4) 组织病理学评估。
网络分析揭示关键靶点
通过STRING数据库构建的蛋白互作网络识别出STAT3、PPARG、GSK3B等10个核心靶点,这些基因富集在氧应激反应、核受体活性等生物过程。特别是STAT3在拓扑分析中显示最高连接度(度值33),与转录调控和炎症反应密切相关。
体内实验验证保护效应
ATZ暴露使大鼠血清ALT升高12.08%,尿素上升87.66%,而10 mg/kg Mn处理能显著逆转这些异常。在分子水平上,Mn使肝组织SOD活性恢复至对照组的92%,肾组织MDA水平降低64%,表明其强大的抗氧化能力。
组织学证据支持
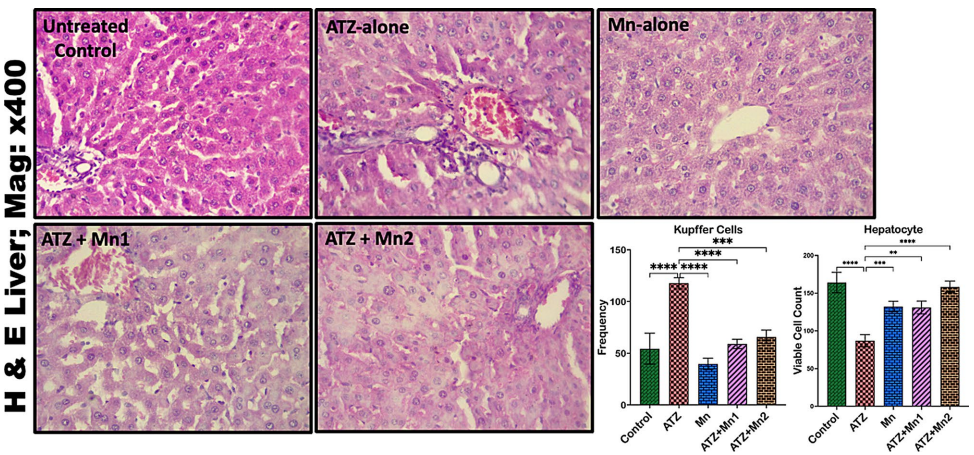
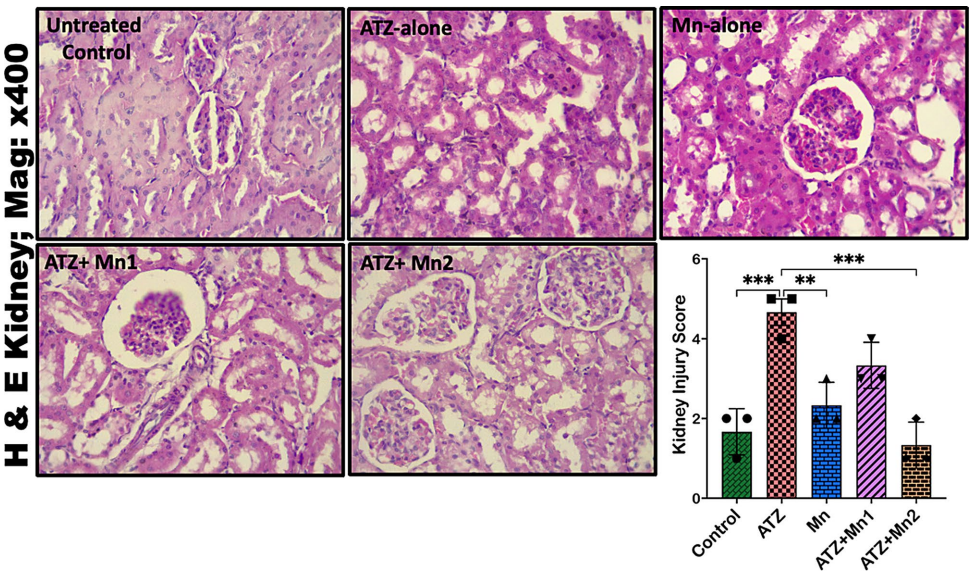
作用机制解析
研究提出Mn通过三重保护机制:1) 增强谷胱甘肽-S-转移酶(GST)介导的ATZ代谢解毒;2) 激活锰超氧化物歧化酶(Mn-SOD)清除O2-;3) 抑制髓过氧化物酶(MPO)减少ONOO-生成。这与网络分析发现的HIF1A/MTOR等靶点调控氧化应激通路的结果高度吻合。
这项研究的重要意义在于:首次系统阐释了Mn通过"多靶点-多通路"模式对抗环境毒素的分子机制,为开发基于微量元素的解毒策略提供了理论依据。特别是STAT3/PPARG等hub基因的发现,为后续药物开发指明了方向。考虑到Mn的安全剂量窗较窄(2-9 mg/天),该研究也为精准剂量设计提供了实验基础。未来研究可进一步探索这些靶点在人群中的调控规律,推动实验室发现向临床应用转化。
 生物通微信公众号
生物通微信公众号
知名企业招聘