
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:YAP/TAZ的翻译后修饰:分子机制与治疗机遇
【字体: 大 中 小 】 时间:2025年07月19日 来源:Cellular & Molecular Biology Letters 9.2
编辑推荐:
这篇综述系统梳理了Hippo通路关键效应分子YAP/TAZ的翻译后修饰(PTMs)网络,揭示了磷酸化、泛素化等修饰通过调控其稳定性、亚细胞定位和转录活性参与肿瘤(如HCC、TNBC)、心血管疾病等病理过程的分子机制,为开发靶向YAP/TAZ的治疗策略提供了新视角。
YAP/TAZ:细胞命运的分子开关
作为Hippo信号通路的核心效应分子,Yes相关蛋白(YAP)及其同源物PDZ结合基序转录共激活因子(TAZ)在器官发育和组织稳态中扮演关键角色。这对转录共激活因子虽缺乏DNA结合域,却通过与TEAD、SMAD等转录因子相互作用,调控细胞增殖、分化、代谢等重要生理过程。值得注意的是,它们的生物学功能呈现出显著的"环境依赖性"——在肝癌中促进肿瘤发生,却在某些乳腺癌亚型中表现出抑癌特性。这种功能多样性的背后,隐藏着精密的翻译后修饰调控网络。
Hippo依赖与非依赖的双重调控
经典Hippo通路通过激酶级联反应调控YAP/TAZ活性。当MST1/2激酶激活LATS1/2时,YAP在Ser127、Ser381等位点发生磷酸化,与14-3-3蛋白结合滞留胞质,进而被SCFβ-TRCP泛素化降解。有趣的是,细胞连接、机械应力等微环境信号既能通过Hippo通路间接调控YAP/TAZ,也能直接作用于这些蛋白。例如,高渗应激通过NLK激酶促使YAP Ser128磷酸化,阻断Ser127修饰,促进其核转位。这种"双轨制"调控使细胞能快速响应复杂的环境变化。
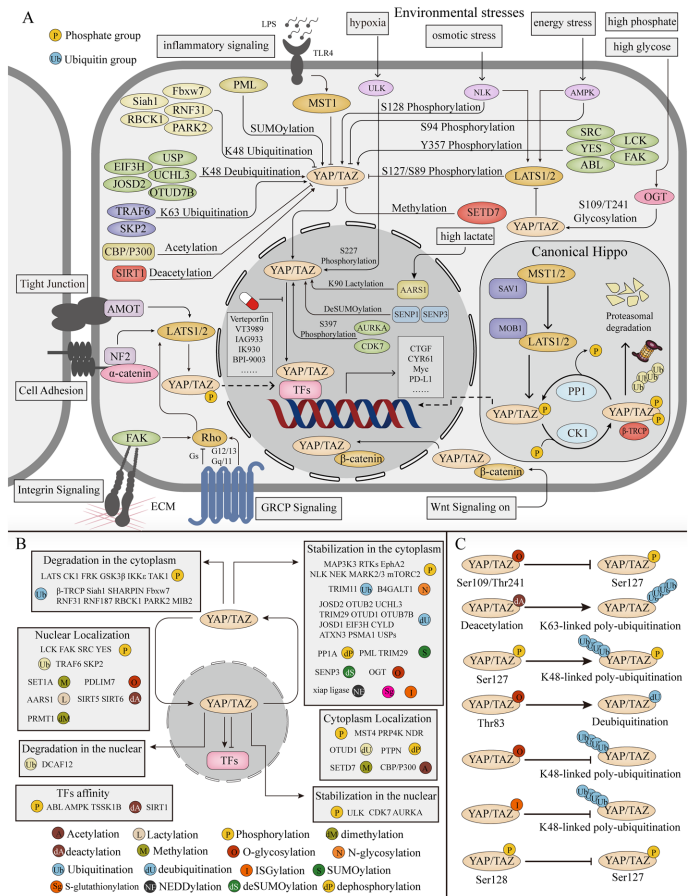
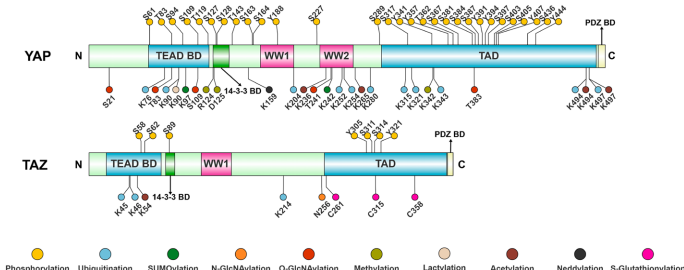
磷酸化修饰的"分子密码"
YAP/TAZ的磷酸化图谱犹如一套精密密码。LATS介导的Ser127磷酸化促进胞质滞留,而SRC家族激酶催化的Tyr357磷酸化则增强核定位。在能量应激时,AMPK通过磷酸化Ser94破坏YAP-TEAD相互作用,抑制肿瘤发生。更复杂的是,Aurora A激酶在核内磷酸化Ser397可稳定YAP,而缺氧条件下ULK1/2对Ser227的磷酸化同样具有抗降解作用。这些位点特异性磷酸化构成了响应不同刺激的"分子开关"。
泛素化:蛋白命运的"分子标签"
泛素化修饰决定YAP/TAZ的最终归宿。K48连接的多泛素化(如β-TRCP介导)引导蛋白酶体降解,而K63连接形式(如TRAF6催化)则促进核转位。去泛素化酶USP家族成员(USP9X、USP10等)通过移除这些"死亡标签"稳定YAP/TAZ,在肿瘤耐药中起关键作用。值得注意的是,E3连接酶TRIM15通过非降解性K48泛素化破坏YAP-AMOT相互作用,创新性地揭示了泛素化修饰的功能多样性。
新兴修饰的调控潜力
除经典修饰外,新型PTMs不断拓展认知边界:
这些发现为理解YAP/TAZ在代谢疾病、纤维化等病理过程中的作用提供了新视角。
治疗机遇与挑战
靶向YAP/TAZ面临三大策略:
展望未来,解析不同组织微环境中PTMs的动态变化、开发位点特异性调控工具,将是实现精准干预的关键。YAP/TAZ翻译后修饰网络的解密,正为攻克癌症等多种疾病开辟充满希望的新战线。
 生物通微信公众号
生物通微信公众号
知名企业招聘