
-

生物通官微
陪你抓住生命科技
跳动的脉搏
RBM15通过m6A修饰调控ACSL4表达促进心肌细胞缺氧/复氧诱导的铁死亡
【字体: 大 中 小 】 时间:2025年07月19日 来源:Hereditas 2.1
编辑推荐:
本研究针对急性心肌梗死(AMI)后心肌缺血再灌注(I/R)损伤的机制展开探索,发现RNA结合基序蛋白15(RBM15)通过介导酰基辅酶A合成酶长链家族成员4(ACSL4)的m6A甲基化修饰,加剧缺氧/复氧(H/R)诱导的心肌细胞铁死亡。重庆医科大学附属璧山医院的研究团队采用AC16心肌细胞H/R模型,结合m6A定量分析、RNA免疫共沉淀等技术,首次揭示RBM15/ACSL4轴在心肌I/R损伤中的关键作用,为AMI治疗提供了新靶点。
心血管疾病是全球首要死因,其中急性心肌梗死(AMI)因其高致死率备受关注。尽管及时恢复血流灌注是治疗AMI的关键,但随之而来的心肌缺血再灌注(I/R)损伤却成为临床难题。近年研究发现,铁死亡(Ferroptosis)这种新型程序性细胞死亡方式在心肌I/R损伤中扮演重要角色,其特征是铁离子蓄积、谷胱甘肽耗竭和脂质过氧化。然而,铁死亡在心肌损伤中的精确调控机制尚不明确,特别是表观遗传修饰如何参与这一过程仍有待探索。
重庆医科大学附属璧山医院老年医学科的Yi Cheng等研究人员在《Hereditas》发表的研究,首次揭示了RNA结合基序蛋白15(RBM15)通过N6-甲基腺苷(m6A)修饰调控酰基辅酶A合成酶长链家族成员4(ACSL4)表达,进而影响心肌细胞铁死亡的分子机制。这项研究不仅为理解心肌I/R损伤提供了新视角,更为开发靶向干预策略奠定了理论基础。
研究人员采用多种关键技术方法:收集65例AMI患者血清样本进行生物标志物分析;建立AC16心肌细胞缺氧/复氧(H/R)模型模拟I/R损伤;运用CCK-8检测细胞活力,商业试剂盒测定氧化应激指标;通过RNA免疫共沉淀(RIP)和甲基化RNA免疫共沉淀(meRIP)验证RBM15与ACSL4的相互作用;采用双荧光素酶报告基因和放线菌素D处理分析mRNA稳定性;最后通过小鼠AMI模型进行体内验证。
研究结果部分,首先在"RBM15 was upregulated in AMI patients' serums"中发现,AMI患者血清中RBM15表达显著升高,且与心肌损伤标志物cTnI和CK-MB呈正相关,ROC曲线下面积达0.9754,显示其作为诊断标志物的潜力。

"RBM15 knockdown inhibited H/R-induced oxidative injury in AC16 cells"部分显示,沉默RBM15可显著改善H/R导致的细胞活力下降,降低乳酸脱氢酶(LDH)释放、活性氧(ROS)和丙二醛(MDA)水平,同时提高超氧化物歧化酶(SOD)活性。

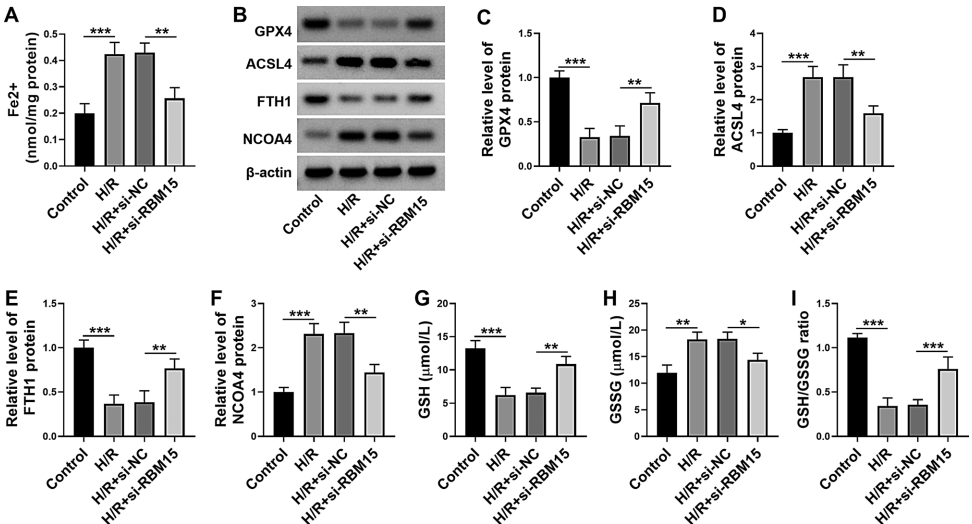
在"Silencing of RBM15 inhibited H/R-induced ferroptosis in AC16 cells"中,研究发现RBM15敲除降低了H/R诱导的铁离子(Fe2+)蓄积,上调了谷胱甘肽过氧化物酶4(GPX4)和铁蛋白重链1(FTH1)表达,同时下调了ACSL4和核受体共激活因子4(NCOA4)水平,改善了氧化型谷胱甘肽(GSSG)/还原型谷胱甘肽(GSH)比值。
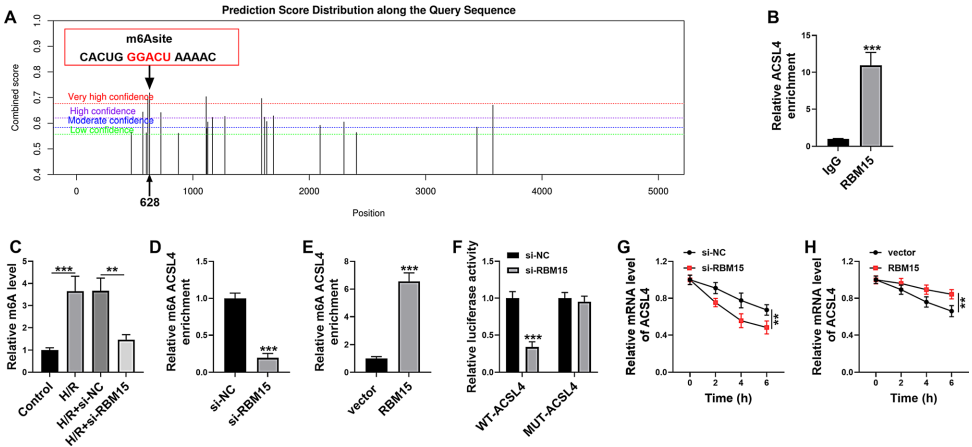
"RBM15 mediated m6A modification of ACSL4"部分通过生物信息学预测和实验验证,证实RBM15通过m6A修饰增强ACSL4 mRNA稳定性。meRIP和双荧光素酶报告实验显示,RBM15可直接结合ACSL4并促进其m6A修饰,而放线菌素D处理证实RBM15调控ACSL4 mRNA稳定性。
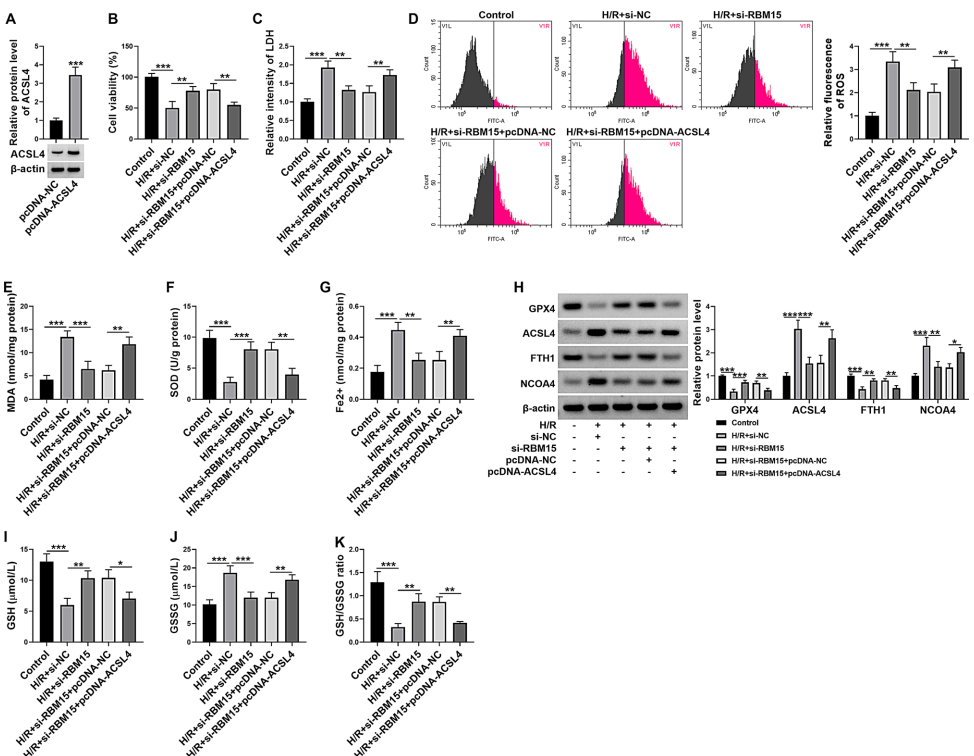
最后,"Overexpression of ACSL4 restored the effect of RBM15 knockdown"证明ACSL4过表达可逆转RBM15沉默对H/R损伤的保护作用,验证了RBM15/ACSL4轴的调控关系。
这项研究系统阐明了RBM15通过m6A依赖性机制调控ACSL4表达,进而促进心肌细胞铁死亡的分子通路。

 生物通微信公众号
生物通微信公众号
知名企业招聘