
-

生物通官微
陪你抓住生命科技
跳动的脉搏
NT5M通过CXCL8/PD-L1轴调控胰腺癌免疫逃逸:新型预后标志物与治疗靶点
【字体: 大 中 小 】 时间:2025年07月20日 来源:Scientific Reports 3.8
编辑推荐:
为解决胰腺腺癌(PAAD)的高侵袭性、免疫抑制微环境及免疫治疗耐药难题,南昌大学第二附属医院团队通过整合生物信息学分析与体外实验,首次揭示核苷酸代谢酶NT5M通过下调CXCL8抑制PD-L1表达,逆转免疫逃避的分子机制。研究表明,NT5M低表达与PAAD患者不良预后显著相关,且通过激活CXCL8/PD-L1轴促进CD8+ T细胞功能抑制。该发现为PAAD提供了新型预后标志物,并为增强免疫检查点阻断疗法疗效提出靶向NT5M代谢通路的新策略。
胰腺腺癌(PAAD)作为消化系统恶性程度最高的肿瘤之一,因诊断滞后、侵袭性强及对常规疗法响应率低,五年生存率不足12%。其高度免疫抑制性微环境(TME)中,PD-L1介导的免疫检查点通路是导致T细胞功能耗竭的关键因素,但现有PD-1/PD-L1抑制剂单药疗效有限。核苷酸代谢异常在肿瘤进展中的作用近年备受关注,然而线粒体5'-核苷酸酶NT5M在PAAD中的功能仍属未知。
南昌大学第二附属医院周帆团队通过多组学整合分析,首次揭示NT5M在PAAD中的双重作用:既是独立预后标志物,又是逆转免疫逃避的代谢调控枢纽。研究人员利用TCGA、GEO等公共数据库进行差异表达基因筛选、生存关联分析和免疫浸润评估,结合单细胞转录组测序(scRNA-seq)解析细胞异质性,并通过体外实验在PANC-1、BxPC-3细胞系中验证NT5M功能。关键实验包括:质粒介导的基因过表达、CCK-8/EdU增殖检测、Transwell侵袭实验、PBMCs(外周血单核细胞)共培养免疫逃逸模型,以及Western blot和qPCR验证信号通路。
研究结果核心发现
1. NT5M作为PAAD新型预后标志物
通过TCGA-PAAD队列分析,NT5M在癌组织中表达显著低于正常组织(p<0.001)
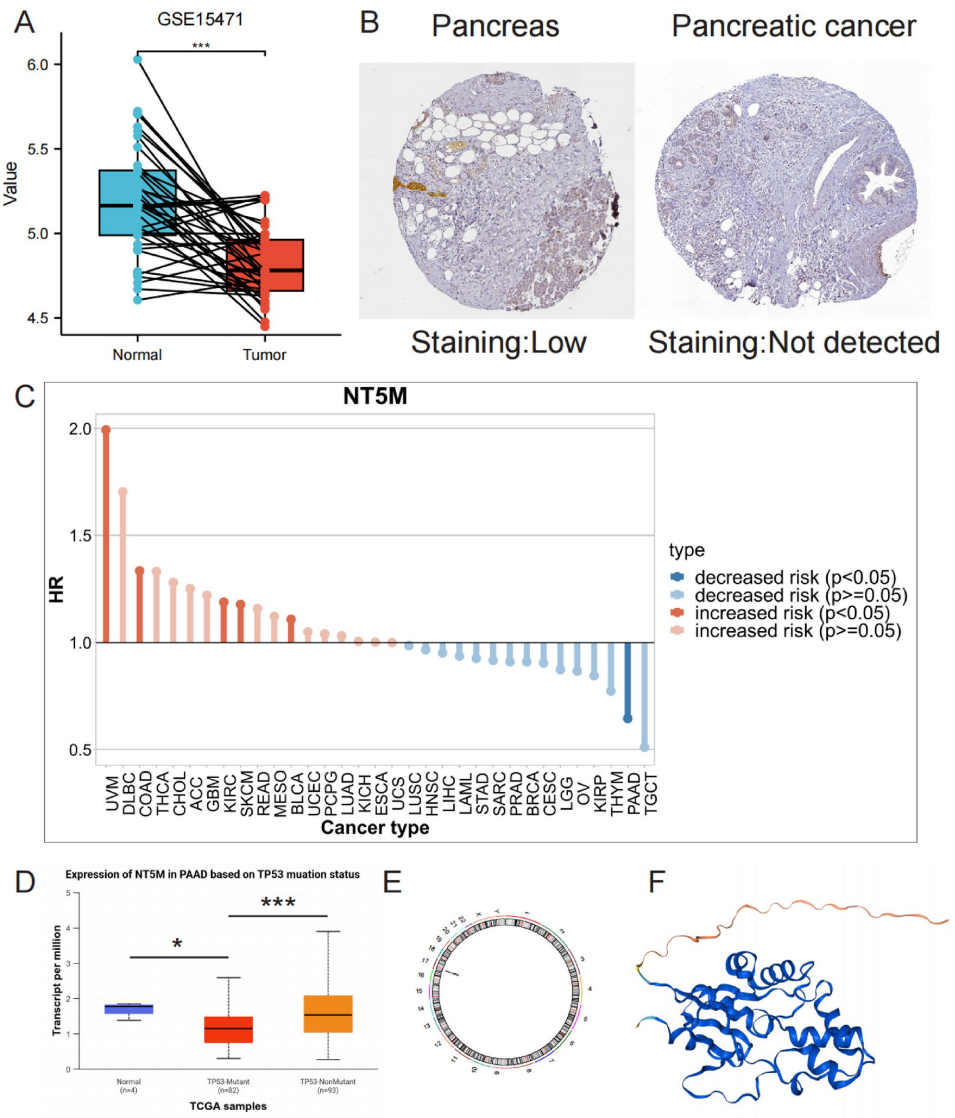
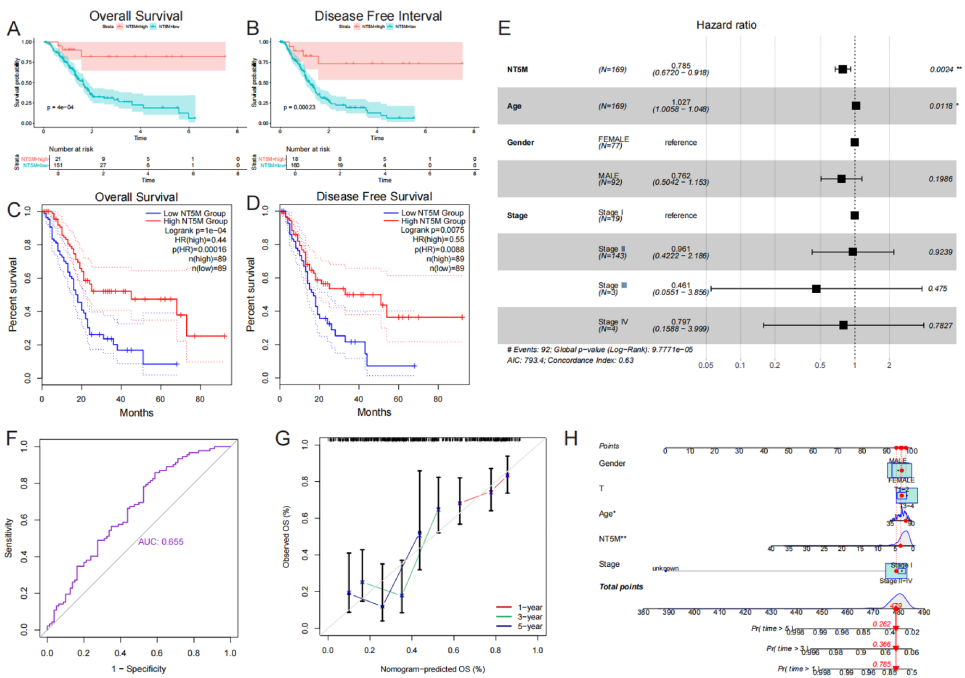
2. NT5M调控免疫微环境重塑
单细胞测序显示NT5M在恶性细胞中表达缺失,而在免疫/基质细胞富集
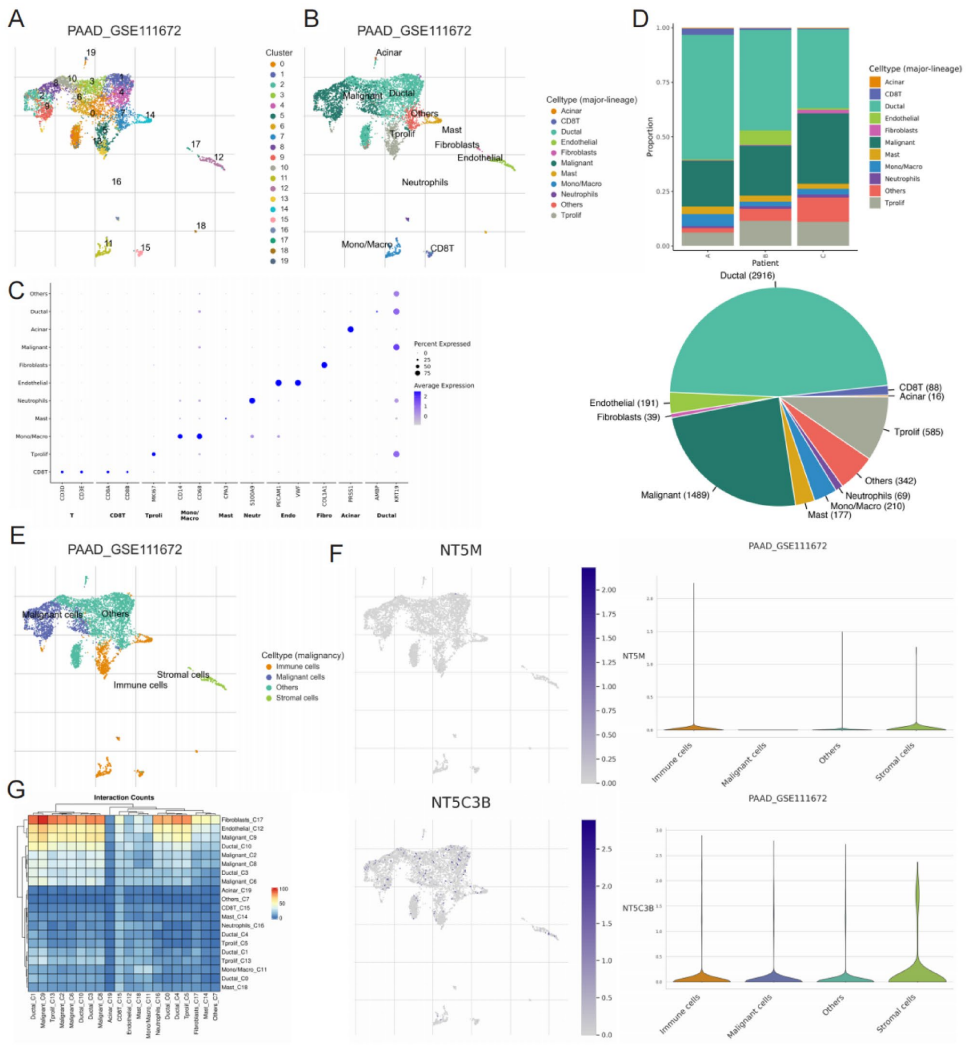
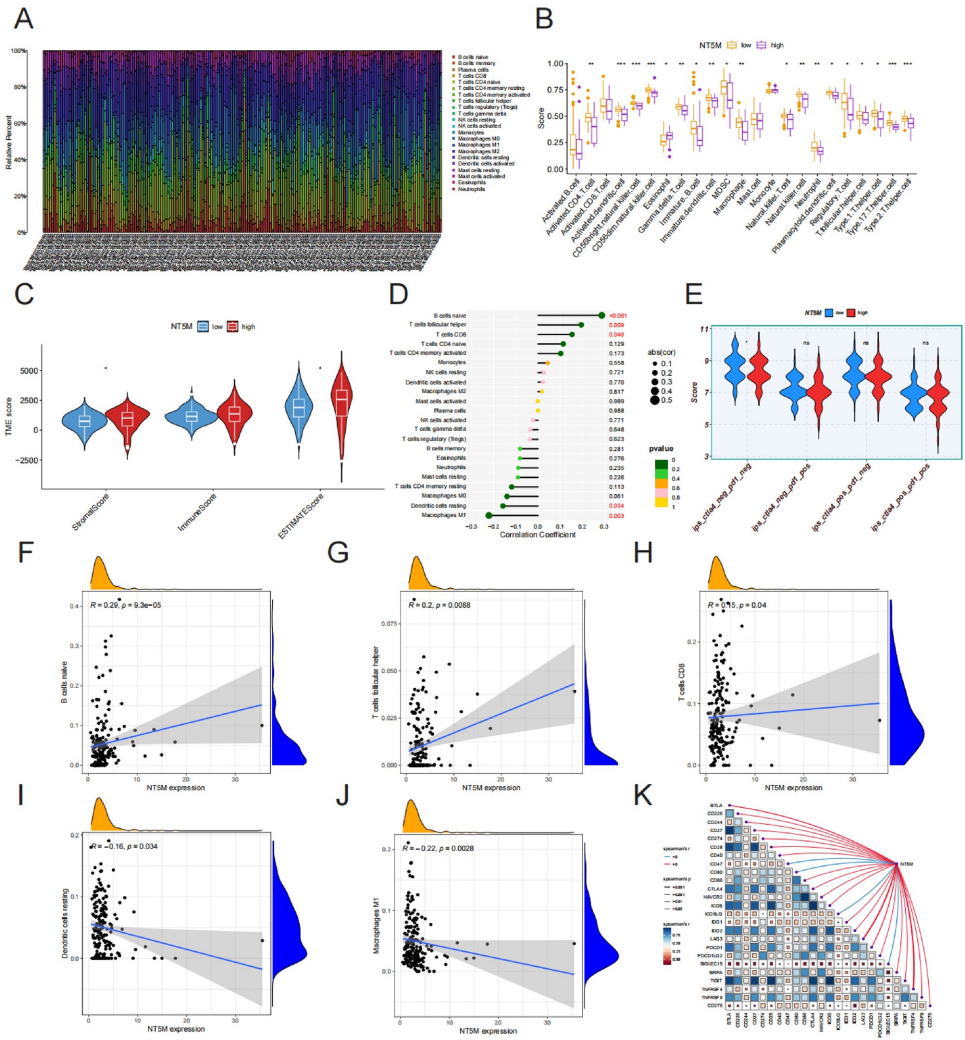
3. NT5M/CXCL8/PD-L1轴机制解析
体外过表达NT5M使PAAD细胞PD-L1蛋白水平下降60%(p<0.01)
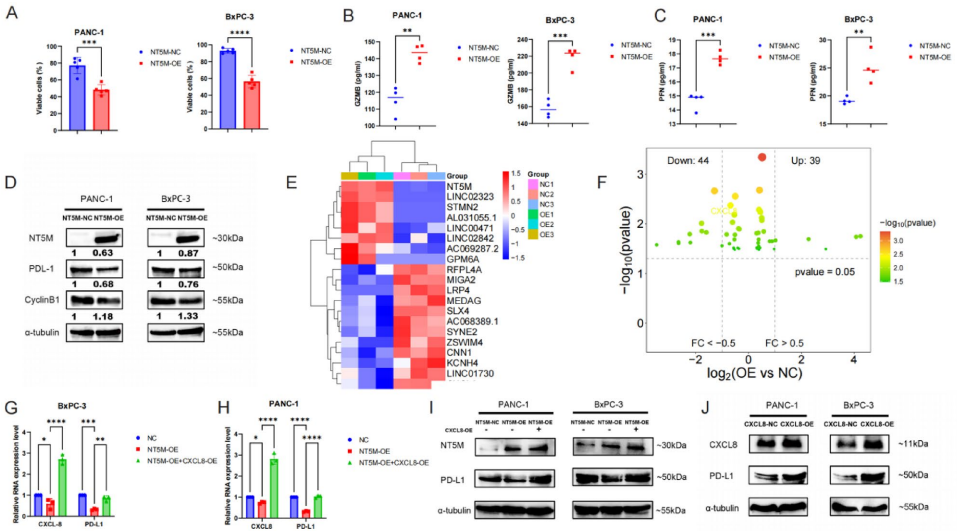
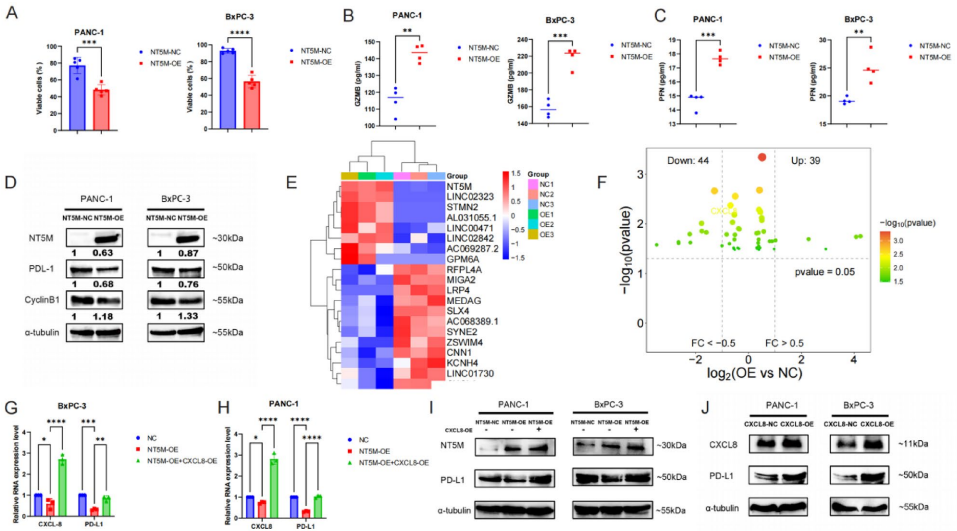
4. NT5M抑制肿瘤恶性行为
功能实验表明,过表达NT5M使PAAD细胞增殖率降低40%(EdU检测,p<0.01),侵袭能力下降55%(Transwell,p<0.001)
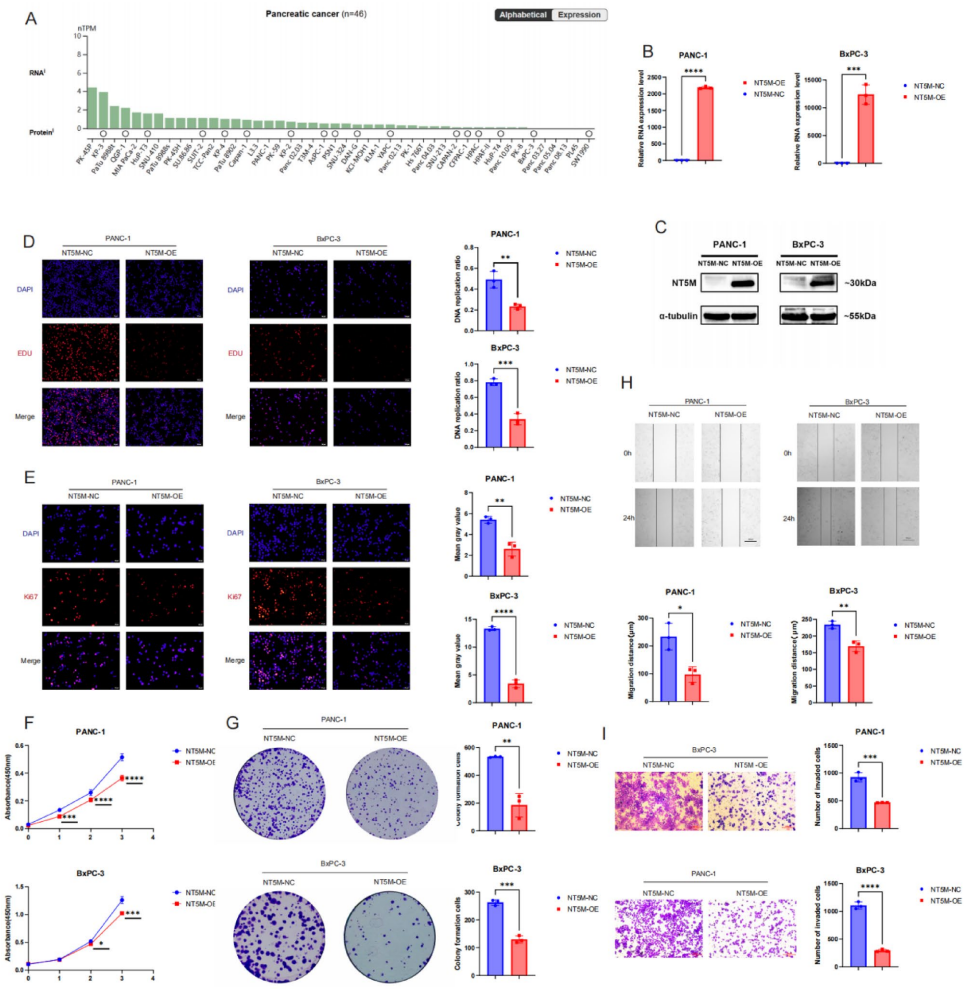
结论与意义
本研究首次阐明NT5M通过抑制CXCL8/PD-L1信号轴逆转PAAD免疫逃逸的双重机制:一方面作为独立预后标志物,其低表达提示晚期进展与不良生存;另一方面作为代谢-免疫交叉调控节点,通过阻断CXCL8-PD-L1通路激活抗肿瘤免疫应答。该发现为破解胰腺癌"冷肿瘤"特性提供新视角:靶向NT5M可能克服PD-1/PD-L1抑制剂耐药,且其表达水平可指导化疗药物(如吉西他滨)与免疫治疗的联合策略。研究发表于《Scientific Reports》,为代谢重编程与免疫微环境互作理论增添关键证据,并为临床转化提供潜在靶点。
 生物通微信公众号
生物通微信公众号
知名企业招聘