
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:工程化外泌体在眼部血管疾病治疗中的最新进展
【字体: 大 中 小 】 时间:2025年07月21日 来源:Journal of Nanobiotechnology 10.6
编辑推荐:
这篇综述系统阐述了工程化外泌体(exosomes)作为创新药物递送平台在治疗角膜新生血管(CoNV)、年龄相关性黄斑变性(AMD)和糖尿病视网膜病变(DR)等眼部新生血管疾病(ONDs)中的应用。作者团队来自中国医科大学,详细分析了外泌体的生物物理特性、工程化改造策略(如RVG肽修饰和RGD靶向),及其通过调控VEGF/HIF-1α轴、Angiopoietin/Tie2通路和miR-126-3p等分子机制实现精准治疗的优势,为克服当前抗VEGF疗法的耐药性和频繁注射问题提供了新思路。
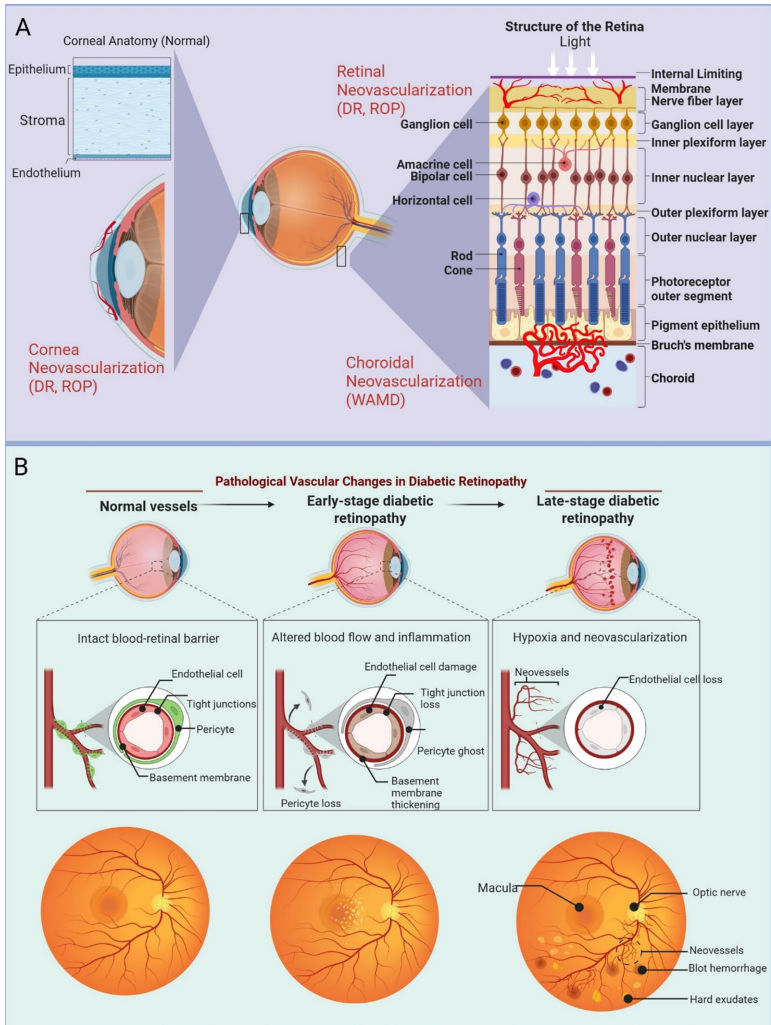
眼部新生血管疾病(ONDs)主要包括角膜新生血管(CoNV)、湿性年龄相关性黄斑变性(wAMD)和糖尿病视网膜病变(DR),是全球视力障碍的主要原因。这些疾病的共同特征是病理性血管生成、炎症和纤维化,其中VEGF/HIF-1α信号轴起核心调控作用。在缺氧条件下,HIF-1α稳定表达并上调VEGF,促进内皮细胞增殖和渗漏性新生血管形成。慢性炎症通过释放TNF-α、IL-6等细胞因子加剧血管损伤,而氧化应激则通过活性氧(ROS)破坏血-视网膜屏障(BRB)完整性。
外泌体是直径30-150 nm的天然细胞外囊泡,由多泡体(MVBs)分泌形成,具有脂质双分子层结构。其表面富含CD9、CD63等四跨膜蛋白,可携带蛋白质、miRNA和mRNA等生物活性分子。相较于合成纳米颗粒,外泌体具有低免疫原性、优异生物相容性和天然靶向性三大优势。通过电穿孔或超声加载技术,可将抗VEGF siRNA、miR-126-3p等治疗分子高效封装入外泌体。

为提高靶向性,研究者开发了多种表面修饰技术:
角膜新生血管:MSC外泌体负载miR-21可加速角膜上皮伤口愈合,而黑色素瘤细胞外泌体(B16-Exo)通过JAK2/STAT通路抑制移植排斥反应。

糖尿病视网膜病变:EXOKV11修饰的外泌体显著减少视网膜无血管区,而MSC外泌体通过递送miR-146a抑制NF-κB炎症通路。
湿性AMD:铁氧化物纳米颗粒工程化外泌体(ESIONPs@EXO)靶向抑制脉络膜新生血管(CNV),其机制涉及调控巨噬细胞M2型极化。

当前面临三大瓶颈:1)大规模生产时的批次差异;2)静脉给药时的肝脏清除;3)长期安全性数据缺乏。未来发展方向包括:开发"智能响应型"外泌体(如低氧触发释放系统)、建立标准化质控体系、探索与抗VEGF药物的联合治疗方案。随着CP05锚定肽等新技术的应用,外泌体有望实现从每月注射到长效缓释的治疗模式转变。
 生物通微信公众号
生物通微信公众号
知名企业招聘