
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:白藜芦醇负载水凝胶用于癌症靶向与多模式治疗的协同策略研究
【字体: 大 中 小 】 时间:2025年07月22日 来源:Discover Oncology 2.8
编辑推荐:
这篇综述系统探讨了白藜芦醇(RSV)与水凝胶递送系统的协同抗肿瘤机制。作者指出RSV通过抑制Wnt/β-catenin、PI3K/Akt等通路发挥多靶点作用,但面临代谢快、生物利用度低(<5%)等挑战。水凝胶凭借pH/温度响应性、自修复等特性,可提升RSV稳定性(包封率≈80%)并实现肿瘤微环境(TME)触发释放,在结直肠癌(抑制β-catenin核转位58%)和胶质母细胞瘤(ROS响应性释放89%)模型中展现显著疗效。
白藜芦醇(RSV)作为天然多酚,通过多重机制对抗癌症:抑制PI3K/Akt通路(肝癌中p-Akt降低>50%)、阻断Wnt/β-catenin信号(乳腺癌IC50=0.98μM)以及表观遗传调控(胃癌中SEMA3A启动子甲基化降低40%)。然而其临床应用受限于快速代谢(口服生物利用度<5%)和剂量依赖性双相效应——低浓度激活SIRT1促存活,而25μM以上则诱导凋亡。
智能水凝胶通过三大创新克服RSV缺陷:

在结直肠癌中,载药水凝胶使5-氟尿嘧啶(5-FU)凋亡率从22%提升至67%,其机制为:
尽管4D打印水凝胶(如HAMA-GelMA)已实现91%载药效率,但批量生产一致性(孔径偏差>40μm将影响药物分布)和长期生物相容性仍是瓶颈。新兴CRISPR-Cas9共递送系统(如脂质体模板水凝胶)通过PLK1基因编辑与RSV联用,为MYC驱动骨肉瘤提供合成致死策略,但需警惕预存抗Cas9抗体(人群阳性率5-95%)的干扰。
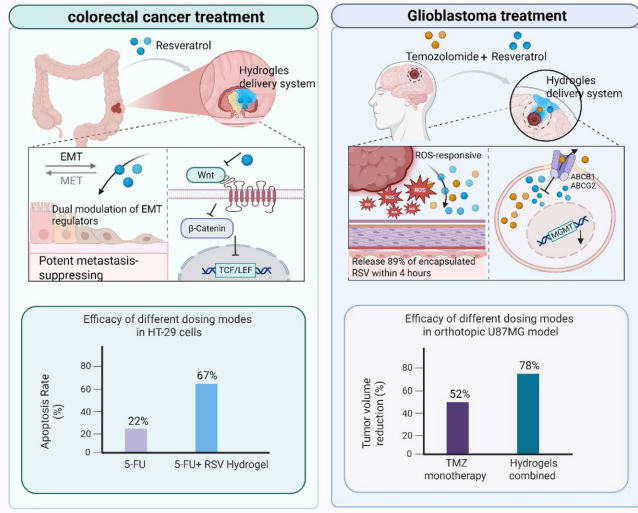
这场水凝胶介导的药物递送革命,正将实验室的分子发现转化为对抗癌症的精准武器,而解决规模化生产与免疫原性平衡将成为下一阶段的主攻方向。
 生物通微信公众号
生物通微信公众号
知名企业招聘