
-

生物通官微
陪你抓住生命科技
跳动的脉搏
黄芪甲苷通过NCOA4介导的铁蛋白自噬促进肝星状细胞铁死亡缓解斑马鱼和小鼠肝纤维化的机制研究
【字体: 大 中 小 】 时间:2025年07月23日 来源:Communications Biology 5.2
编辑推荐:
本研究针对肝纤维化治疗难题,发现黄芪甲苷(Astragalin, Ag)通过激活NCOA4介导的铁蛋白自噬(ferritinophagy)通路,诱导肝星状细胞(HSCs)铁死亡(ferroptosis),在斑马鱼和小鼠模型中显著改善肝纤维化。研究揭示了Ag通过促进铁过载和脂质过氧化选择性清除活化HSCs的新机制,为天然药物靶向治疗肝纤维化提供了重要理论依据。
肝纤维化作为慢性肝病发展的关键病理过程,影响着全球约38%的非酒精性脂肪肝患者和3亿慢性乙肝患者。尽管目前治疗策略已从病因治疗转向靶向纤维化通路,但针对肝星状细胞(HSCs)活化的特异性干预仍面临挑战。近年来,诱导HSCs铁死亡(ferroptosis)成为抗纤维化研究的新方向,其中铁蛋白自噬(ferritinophagy)通过核受体共激活因子4(NCOA4)介导的铁代谢调控尤为引人注目。传统中药黄芪中的活性成分黄芪甲苷(Astragalin, Ag)虽已知具有抗氧化和抗炎作用,但其抗纤维化机制尚未阐明。
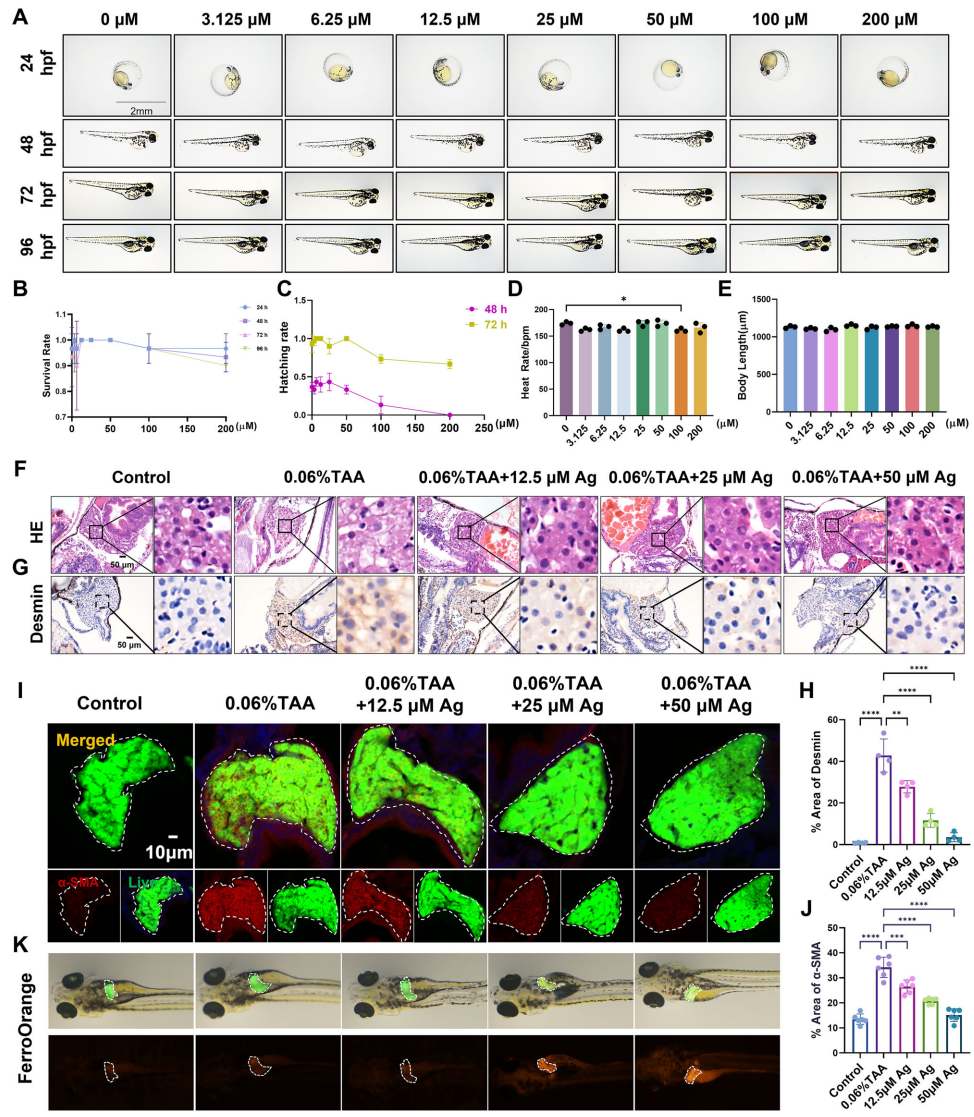
南方医科大学的研究团队在《Communications Biology》发表的研究中,系统揭示了Ag通过NCOA4-ferritinophagy-Ferroptosis轴缓解肝纤维化的新机制。研究采用斑马鱼硫代乙酰胺(TAA)模型、小鼠四氯化碳(CCL4)模型及HSC-T6、JS-1细胞系,结合分子对接、透射电镜(TEM)和流式分选等技术,证实Ag在安全剂量范围内(斑马鱼0-50μM,小鼠20 mg/kg)能特异性诱导活化HSCs铁死亡,而对肝细胞和巨噬细胞无显著影响。
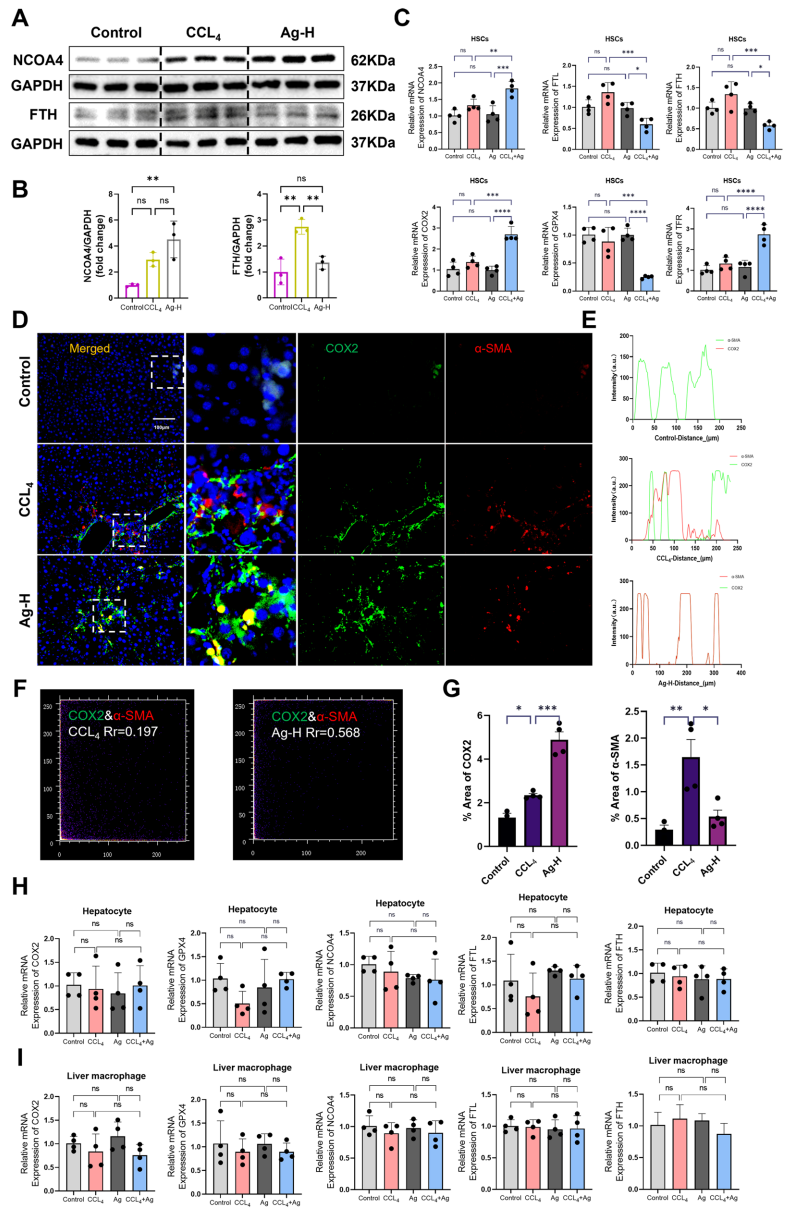
研究首先在斑马鱼模型中证实Ag(12.5-50μM)可剂量依赖性改善TAA诱导的肝纤维化,伴随肝组织Fe2+含量升高。分子对接显示Ag与NCOA4结合能为-5.6 kcal/mol,与铁死亡关键蛋白GPX4(-6.7 kcal/mol)和DMT1(-6.7 kcal/mol)也有强亲和力。体外实验发现Ag处理显著上调HSC-T6细胞中NCOA4和LC3B II表达,降低p62和铁蛋白轻链(FTL)水平,透射电镜观察到自噬体增多和线粒体嵴断裂等铁死亡特征。通过C11 BODIPY581/591探针检测证实Ag处理组脂质过氧化水平显著升高,JC-1探针显示线粒体膜电位下降。
机制研究发现,自噬抑制剂氯喹(CQ)或NCOA4 siRNA处理可减弱Ag的抗纤维化效果。在CCL4诱导的小鼠肝纤维化模型中,20 mg/kg Ag治疗显著降低血清ALT、AST和炎症因子(IL-1β、IL-6、TNF-α)水平,Masson和天狼星红染色显示胶原沉积减少。流式分选证实Ag特异性上调肝内HSCs的NCOA4和COX2表达,促进FTH/FTL降解,而对肝细胞和巨噬细胞铁代谢无影响。免疫荧光共定位显示Ag处理后COX2与α-SMA在HSCs中的共定位系数(Pearson's_Rr)从0.197升至0.568。
研究结论表明,Ag通过三重机制发挥抗纤维化作用:(1)特异性激活HSCs中NCOA4介导的铁蛋白自噬,促进铁蛋白降解和游离铁释放;(2)诱导铁过载通过Fenton反应产生活性氧(ROS),引发脂质过氧化;(3)选择性触发活化HSCs铁死亡而不影响正常肝细胞。这一发现不仅阐明了传统中药活性成分的多靶点作用机制,也为开发基于铁死亡诱导剂的精准抗纤维化策略提供了新思路。特别是Ag对HSCs的特异性靶向作用,避免了现有抗纤维化药物常见的肝毒性问题,具有重要的临床转化价值。研究团队建议未来可探索Ag与纳米载体结合,进一步提高其对活化HSCs的靶向递送效率。
 生物通微信公众号
生物通微信公众号
知名企业招聘