
-

生物通官微
陪你抓住生命科技
跳动的脉搏
人源穹窿体复合物结构解析:PARP4与NAD+结合调控货物运输的分子机制
【字体: 大 中 小 】 时间:2025年07月23日 来源:Nature Communications 14.7
编辑推荐:
本研究针对真核生物中保守的巨型核糖核蛋白复合物——穹窿体(vault)的分子功能不明确问题,通过冷冻电镜技术解析了人源穹窿体与PARP4(poly(ADP-ribose) polymerase 4)及NAD+的三元复合物结构,首次揭示了PARP4通过MINT结构域与MVP(major vault protein)的静电互补界面结合,并发现MVP的SPFH结构域存在NAD+结合口袋。研究结合蛋白质组学证实PARP4通过调控穹窿体互作蛋白网络影响其亚细胞定位与货物选择,为理解穹窿体在肿瘤耐药、代谢调控等病理过程中的作用提供新视角。论文发表于《Nature Communications》。
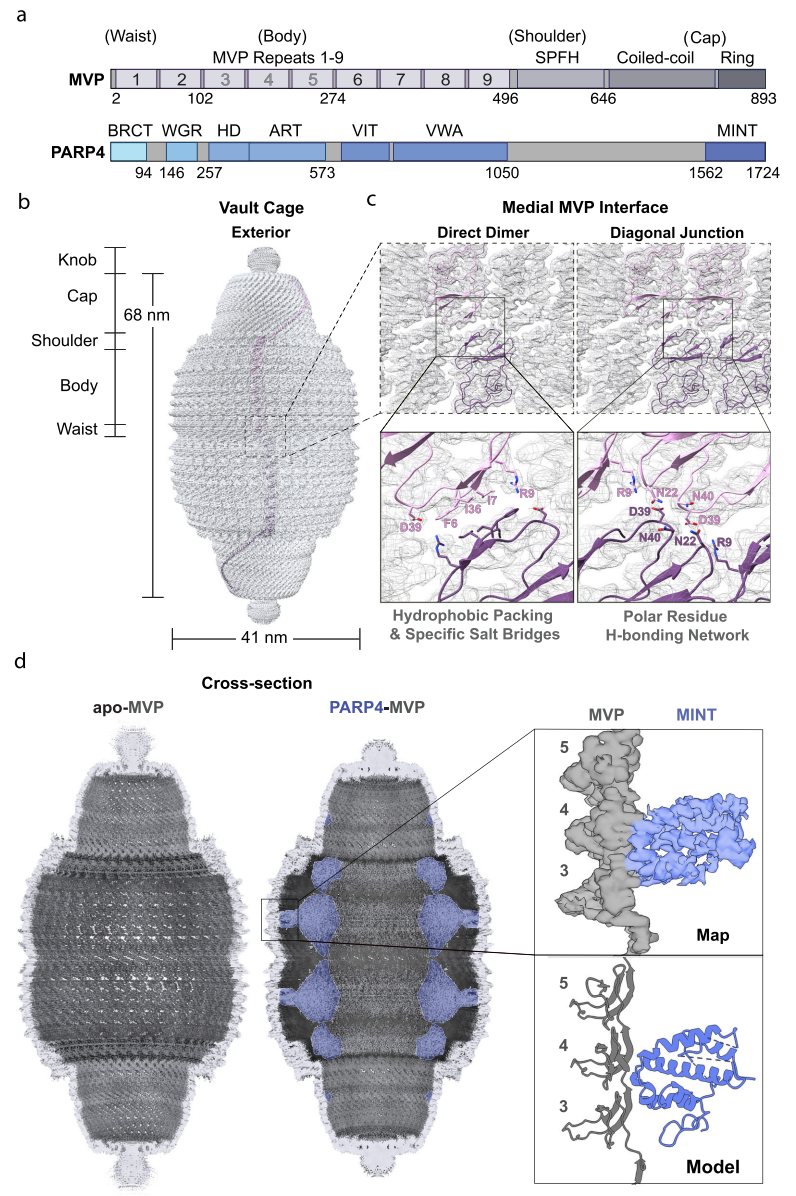
在真核细胞中存在一种神秘的巨型复合物——穹窿体(vault),其形似中世纪教堂的拱顶结构,由78个主要穹窿体蛋白(MVP)单体组装成椭圆形的纳米笼结构。尽管发现已逾三十年,这个"细胞中的诺亚方舟"如何选择运输的"货物"分子、如何响应外界信号等问题始终未解。尤其令人困惑的是,脊椎动物穹窿体中唯一具有酶活性的次要组分PARP4(多聚ADP核糖聚合酶4),如何与MVP结合并发挥功能一直是领域内的未解之谜。
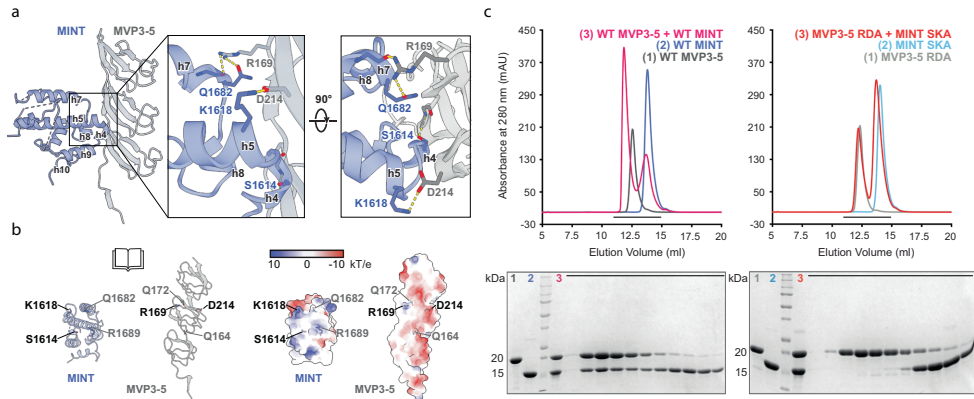
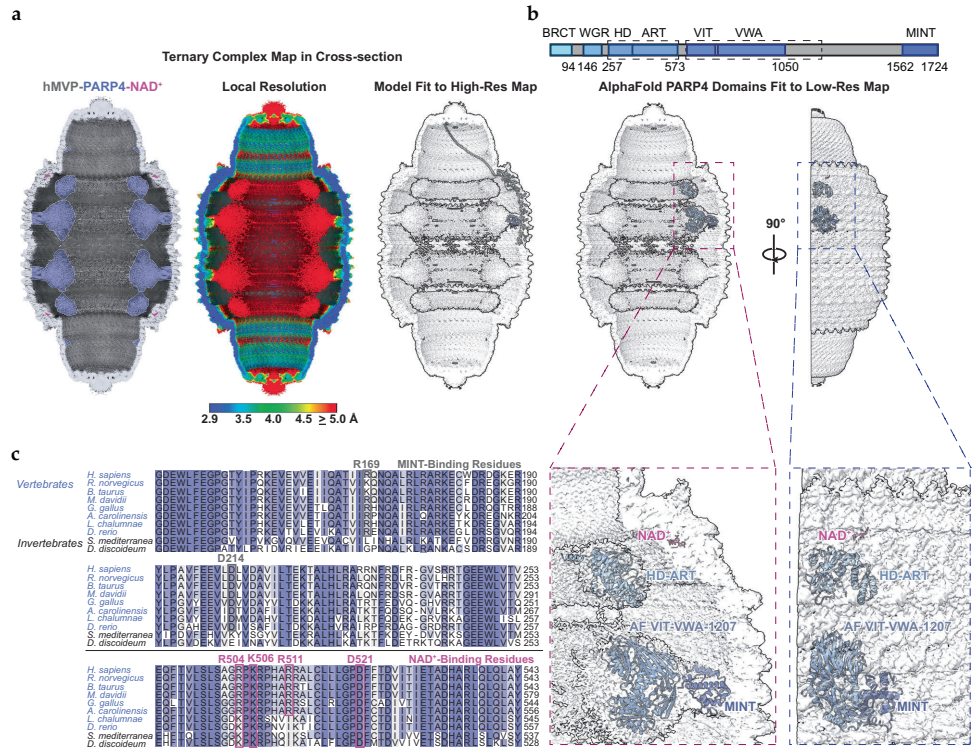
芝加哥大学的研究团队通过冷冻电镜技术首次捕获了人源穹窿体与PARP4及辅酶NAD+的三元复合物结构,分辨率达到2.9?。研究发现PARP4通过其MINT结构域与MVP的3-5重复域形成静电互补界面,关键残基K1618(PARP4)与D214(MVP)的盐桥突变可破坏该相互作用。令人意外的是,在MVP的SPFH(Stomatin/Prohibitin/Flotillin/HflK)结构域中发现了一个全新的NAD+结合口袋,由相邻MVP单体的R511、H509等残基协同稳定NAD+的二磷酸基团。
研究采用昆虫细胞共表达系统获得完整穹窿体复合物,通过冷冻电镜单颗粒分析解析结构;利用等温滴定量热法验证NAD+结合特性;基于CRISPR/Cas9构建PARP4敲除细胞系,结合免疫共沉淀-质谱技术分析穹窿体互作蛋白组;通过分子对接模拟PARP4催化模块与MVP的空间排布。
结构解析揭示PARP4结合机制
冷冻电镜结构显示,PARP4的MINT结构域像"锚"一样固定在穹窿体腰部,其螺旋h4-h5与MVP3-5结构域形成电荷互补界面。关键残基突变实验证实,PARP4的S1614、K1618与MVP的R169、D214构成氢键网络,破坏这些相互作用会导致复合物解离。
NAD+结合口袋的意外发现
在MVP的SPFH结构域界面发现一个带正电的"锁孔"(keyhole loop),可特异性结合NAD+的腺嘌呤和核糖部分。相邻MVP单体的R507和K573中和二磷酸基团的负电荷,而H509与核糖羟基形成氢键。该位点也能结合ADP,提示其可能响应细胞能量状态变化。
PARP4调控穹窿体货物选择
蛋白质组学比较显示,野生型细胞中穹窿体更多结合膜相关蛋白(如SLC25A1线粒体NAD+转运体),而PARP4敲除后则富集核内基因调控蛋白(如锌指蛋白ZNF420)。约30%的野生型特异性互作蛋白是已知的ADP核糖化修饰靶标,暗示PARP4可能通过修饰作用调控货物装载。
这项研究首次在原子水平阐明了穹窿体的"分子身份证"PARP4如何与MVP结合,并意外发现MVP自身具有NAD+存储功能。这种"酶-底物共定位"的巧妙设计提示穹窿体可能是细胞内的"代谢反应器",其通过PARP4的ADP核糖化修饰动态调控货物分子的装载与运输。研究成果不仅为理解穹窿体在肿瘤耐药(如MVP高表达导致化疗药物外排)和免疫应答(如病毒RNA运输)中的作用提供结构基础,也为基于穹窿体的药物递送系统设计提供了精准的分子改造靶点。
 生物通微信公众号
生物通微信公众号
知名企业招聘