
-

生物通官微
陪你抓住生命科技
跳动的脉搏
人类新皮质发育中H3K27me3表观遗传调控细胞外基质组成的新机制
【字体: 大 中 小 】 时间:2025年07月24日 来源:Neuron 14.7
编辑推荐:
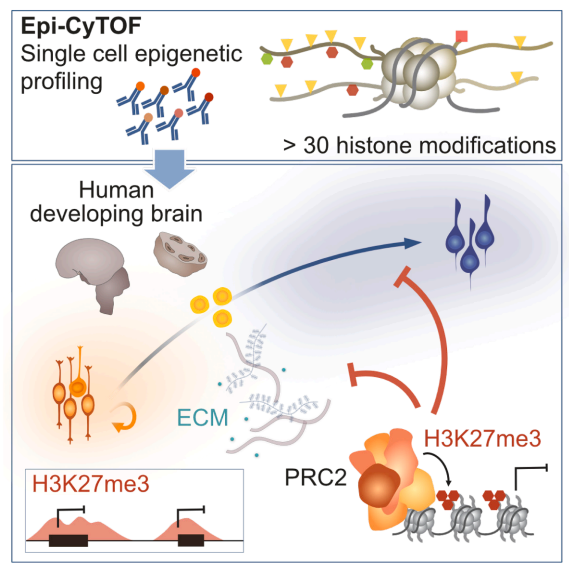
本研究通过创新的Epi-CyTOF单细胞表观组分析技术,揭示了PRC2介导的H3K27me3在人类新皮质发育过程中不仅调控神经前体细胞分化,还通过靶向细胞外基质(ECM)基因非自主性影响神经发生。研究人员发现抑制PRC2会导致Syndecan 1和Laminin α1等ECM成分异常表达,并首次证明表观遗传机制通过重塑神经干细胞微环境调控皮质发育,为神经发育障碍的机制研究提供了新视角。
人类大脑新皮质的发育是一个精密调控的过程,其中神经前体细胞(NPCs)的增殖与分化平衡决定了大脑皮层的最终结构和功能。尽管已知表观遗传调控在这一过程中起关键作用,但人类皮质发育中全局性表观遗传重塑的图谱及其功能机制仍不清楚。更引人关注的是,近年研究发现许多神经发育障碍如Kabuki综合征和Weaver综合征都与表观遗传调控因子突变相关,这提示深入解析皮质发育的表观遗传调控机制具有重要临床意义。
德国德累斯顿工业大学再生治疗中心(Center for Regenerative Therapies TU Dresden)的Mareike Albert团队在《Neuron》发表的重要研究,首次采用高维单细胞表观组分析技术Epi-CyTOF,绘制了人类发育中新皮质的表观遗传景观,并揭示了Polycomb抑制复合体2(PRC2)通过H3K27三甲基化(H3K27me3)调控神经发生和细胞外基质组成的新机制。研究人员结合质谱流式细胞术(Epi-CyTOF)、细胞类型特异性CUT&Tag和脑类器官模型等关键技术,系统分析了GW12-14人类胎儿皮质和体外培养8周的皮质类器官中超过30种表观遗传标记的单细胞分布特征。
研究发现H3K27me3在神经元中特异性富集,是神经细胞类型间差异最显著的表观遗传标记。通过药理学抑制PRC2核心组分EED,研究人员发现H3K27me3缺失会促进神经前体细胞向神经元分化,导致类器官体积减小。基因组学分析意外发现,除了预期的神经分化相关基因外,H3K27me3还特异性标记了大量细胞外基质(ECM)基因,包括Syndecan家族成员和Laminin α1等。功能实验证实PRC2抑制会导致这些ECM蛋白表达异常,提示表观遗传机制通过调控微环境组成影响神经发育。
研究团队设计包含31种表观标记和10种细胞类型抗体的定制化抗体组合,通过质谱流式技术实现在单细胞水平同时检测多种组蛋白修饰。分析发现H3K27me3在神经元中显著富集,而H3K4me2/3在各细胞类型间差异较小。免疫荧光验证显示H3K27me3在皮质板(CP)神经元中高表达,而在脑室区(VZ)和脑室下区(SVZ)的前体细胞中表达较低。
通过荧光激活核分选(FANS)分离放射状胶质细胞(RG)、中间前体细胞(IPs)和神经元,进行CUT&Tag分析发现:神经元中有更多但强度较低的H3K27me3结合位点,而RG和IPs中位点较少但信号更强。差异分析鉴定出3,918个神经元特异和2,301个NPC特异的H3K27me3区域,如神经分化基因TBR1在神经元中特异性获得H3K27me3标记。
使用PRC2特异性抑制剂EED226处理皮质类器官5周后,磷酸化组蛋白H3(PH3)+细胞减少,CTIP2+神经元比例增加,类器官体积显著减小。Epi-CyTOF证实处理后H3K27me3几乎完全消失,伴随H3K27ac增加,而H3K4me2/3等其他修饰无明显变化。
通路分析显示神经元特异性H3K27me3靶基因显著富集于"ECM组织"相关通路。PRC2抑制导致Syndecan 1和Laminin α1蛋白水平在SVZ/CP区异常升高,这些蛋白在维持神经前体细胞增殖中起关键作用。研究首次揭示PRC2可能通过表观遗传调控微环境组成,以非细胞自主方式影响神经发生。
这项研究通过创新性的单细胞多组学方法,系统描绘了人类皮质发育的表观遗传蓝图,突破了传统技术只能分析有限表观标记的局限。发现PRC2-H3K27me3轴通过双重机制调控神经发生:既直接控制神经分化基因表达,又通过重塑ECM组成调节微环境信号。这为理解大脑尺寸异常类神经发育障碍提供了新视角,也为开发靶向表观遗传-微环境互作的干预策略奠定了理论基础。研究建立的人类皮质类器官表观遗传分析平台,为模拟疾病和药物筛选提供了重要工具。
 生物通微信公众号
生物通微信公众号
知名企业招聘