
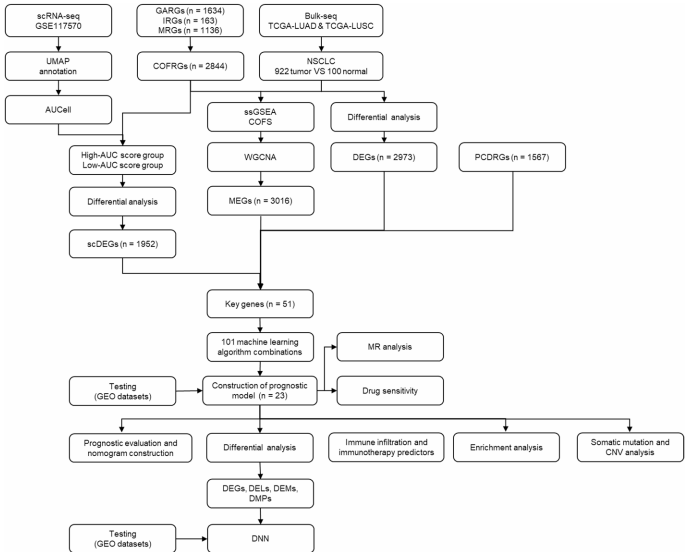
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于23基因多组学特征的NSCLC预后及治疗响应预测模型:整合程序性细胞死亡与细胞器功能的新策略
【字体: 大 中 小 】 时间:2025年07月25日 来源:Discover Oncology 2.8
编辑推荐:
本研究针对非小细胞肺癌(NSCLC)预后评估不精准、免疫治疗响应预测困难等临床挑战,创新性地整合19种程序性细胞死亡(PCD)通路与线粒体/溶酶体/高尔基体功能相关基因,通过单细胞RNA-seq、批量转录组和深度神经网络(DNN)构建23基因预后特征。该模型在四个队列中验证显示优异预测性能(AUC 0.696-0.812),能有效区分免疫抑制微环境的高风险患者,并预测对吉西他滨和PD-1抑制剂的敏感性,为NSCLC个体化治疗提供新工具。
肺癌作为恶性肿瘤死亡的首要原因,其中非小细胞肺癌(NSCLC)占比高达85%,其治疗面临两大困境:传统TNM分期无法准确反映患者异质性,以及免疫检查点抑制剂(ICIs)存在普遍耐药现象。更棘手的是,当前预后模型往往孤立看待细胞死亡通路或细胞器功能,忽视了线粒体-溶酶体-高尔基体网络与程序性细胞死亡(PCD)的复杂互作——这种互作恰恰是影响肿瘤进展和治疗响应的关键环节。
锦州医科大学第一附属医院的研究团队在《Discover Oncology》发表突破性研究,通过整合19种PCD通路(包括新兴的双硫死亡disulfidptosis)和三大细胞器功能基因,构建出首个多维度NSCLC预后特征。研究创新性地采用单细胞转录组解析肿瘤微环境异质性,结合机器学习从2844个细胞器相关基因和1567个PCD基因中筛选出23个核心基因,其中GAPDH(传统"看家基因")意外成为权重最高的预测因子,这与近年发现其参与DNA修复和mTOR信号的新功能不谋而合。
技术方法上,研究团队首先从TCGA和GEO获取NSCLC单细胞及批量转录组数据,通过AUCell算法量化细胞器功能活性,结合WGCNA构建共表达网络。采用10种机器学习算法优化模型,最终选定StepCox+随机生存森林(RSF)组合(λ=0.01)。通过孟德尔随机化(MR)分析验证基因与NSCLC的因果关系,并开发多组学DNN模型整合mRNA/lncRNA/miRNA/甲基化数据。
主要研究结果:
3.1 关键基因鉴定
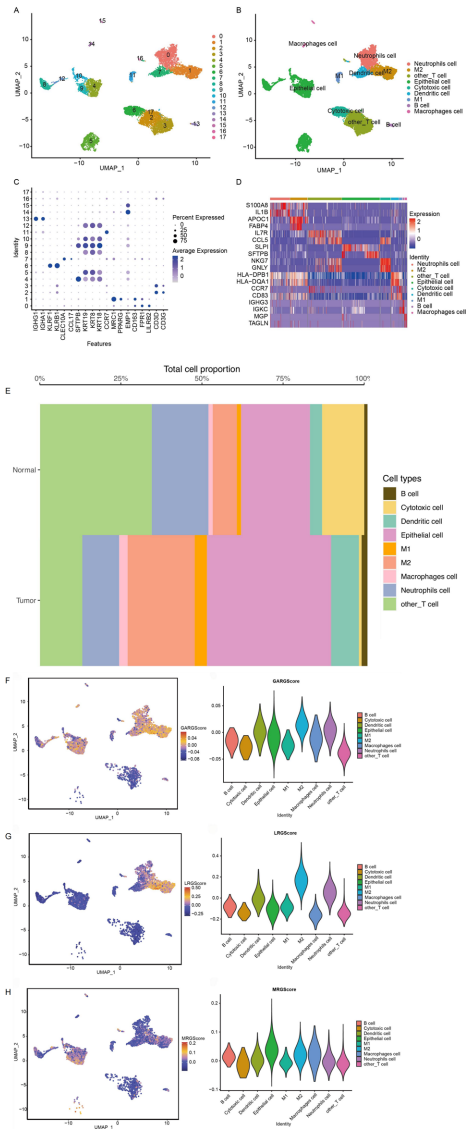
单细胞分析揭示M2巨噬细胞在肿瘤微环境中比例从12%激增至28%,其高表达HIF1A和SQLE基因(与缺氧适应和脂代谢相关)。通过四重交叉验证(PCD相关基因、单细胞差异基因、批量差异基因、模块基因)锁定51个候选基因。
3.2 预后模型构建
23基因特征在TCGA和三个GEO队列中均显著区分高低风险组(p<0.01),其中高风险患者对吉西他滨敏感性增加2.3倍。模型C-index(0.82)超越76个已发表特征,Nomogram将Stage III患者的3年生存率预测精度提升至±5%。
3.6 基因变异特征
高风险组呈现独特的拷贝数变异(CNV)模式,包括15q26.3区段扩增(含SQLE基因)和3p21.31缺失(含BAP1基因),与MR分析结果相互印证。
3.9 孟德尔随机化分析
HIF1A(OR=1.32,p=0.008)和SQLE(OR=1.21,p=0.03)被证实与NSCLC发病存在因果关联,为靶点选择提供遗传学证据。
这项研究的核心突破在于首次建立了PCD-细胞器功能轴与临床预后的定量关联模型。临床转化价值体现在三方面:① 识别可能受益于PD-1抑制剂联合化疗的免疫"冷肿瘤"患者;② 发现GAPDH等非经典靶点的预测价值;③ 甲基化模块使液体活检监测成为可能。局限性在于外部验证队列缺乏甲基化数据,且药物预测需湿实验验证。未来研究可结合空间转录组解析肿瘤微环境内细胞器-PCD的时空互作规律,进一步优化预测精度。
 生物通微信公众号
生物通微信公众号
知名企业招聘