
-

生物通官微
陪你抓住生命科技
跳动的脉搏
CUDC-907通过双重靶向PI3K/HDAC通路精准治疗MEF2D融合阳性B细胞前体急性淋巴细胞白血病
【字体: 大 中 小 】 时间:2025年07月25日 来源:Signal Transduction and Targeted Therapy
编辑推荐:
本研究针对MEF2D融合基因驱动的B细胞前体急性淋巴细胞白血病(BCP-ALL)这一高危亚型,通过高通量药物筛选发现双靶点抑制剂CUDC-907能同时抑制PI3K/AKT信号通路和HDAC9表观遗传调控,在细胞模型、PDX模型及临床样本中均显示显著疗效。该研究揭示了MEF2D融合通过破坏HDAC9负反馈环路和激活pre-BCR-PI3K正反馈环路的双重致癌机制,为融合基因阳性白血病提供了精准治疗策略。
在儿童血液肿瘤领域,B细胞前体急性淋巴细胞白血病(BCP-ALL)的治疗虽已取得显著进展,但存在一类特殊亚型——携带MEF2D融合基因的患者,其5年生存率仅为儿童33.3%、成人15.6%,远低于平均水平。这类白血病因融合基因破坏正常B细胞分化程序,导致细胞阻滞在pre-B阶段,同时异常激活多条致癌通路,对常规化疗方案反应不佳。更棘手的是,MEF2D可与11种不同伙伴基因融合,其中MEF2D::HNRNPUL1(MH)和MEF2D::BCL9(MB)占病例80%以上,但现有治疗手段未能针对其独特分子特征进行精准干预。
上海交通大学医学院附属瑞金医院的研究团队通过系统性研究,在《Signal Transduction and Targeted Therapy》发表重要成果。研究人员首先建立MB融合的PDX模型M2B9Q和MH融合细胞系Kasumi-9,对5512种化合物进行高通量筛选,发现临床阶段药物CUDC-907——一种同时靶向PI3K和HDAC的双重抑制剂,对MEF2D融合阳性细胞具有纳摩尔级杀伤效力(IC50 11.3-14.5 nM),且选择性优于非融合细胞(IC50>450 nM)。分子对接显示其通过竞争PI3K的ATP结合口袋和占据HDAC9锌离子结合域实现双重抑制(结合常数KD分别为9.96 nM和18.2 nM)。
关键技术包括:1)建立MEF2D::BCL9 PDX模型及原代细胞体外培养系统;2)全基因组尺度表观遗传分析(H3K9Ac/H3K56Ac ChIP-seq、ATAC-seq);3)跨组学整合分析(RNA-seq与药物响应谱关联);4)MH/NRASG12D基因工程小鼠与PDX模型的疗效验证。
分子机制解析
通过超级增强子(SE)分析发现,MH和MB细胞中PI3K/AKT通路基因(PIK3CB、BLNK等)和B细胞活化基因(TNFRSF13B)均位于SE区域。CUDC-907处理显著增加H3K9/56乙酰化水平,激活FOXO1及其下游淋巴细胞分化相关基因(IRF4、RAG1),同时抑制pre-BCR信号通路关键分子(VPREB1、IGLL1)。
双重调控机制
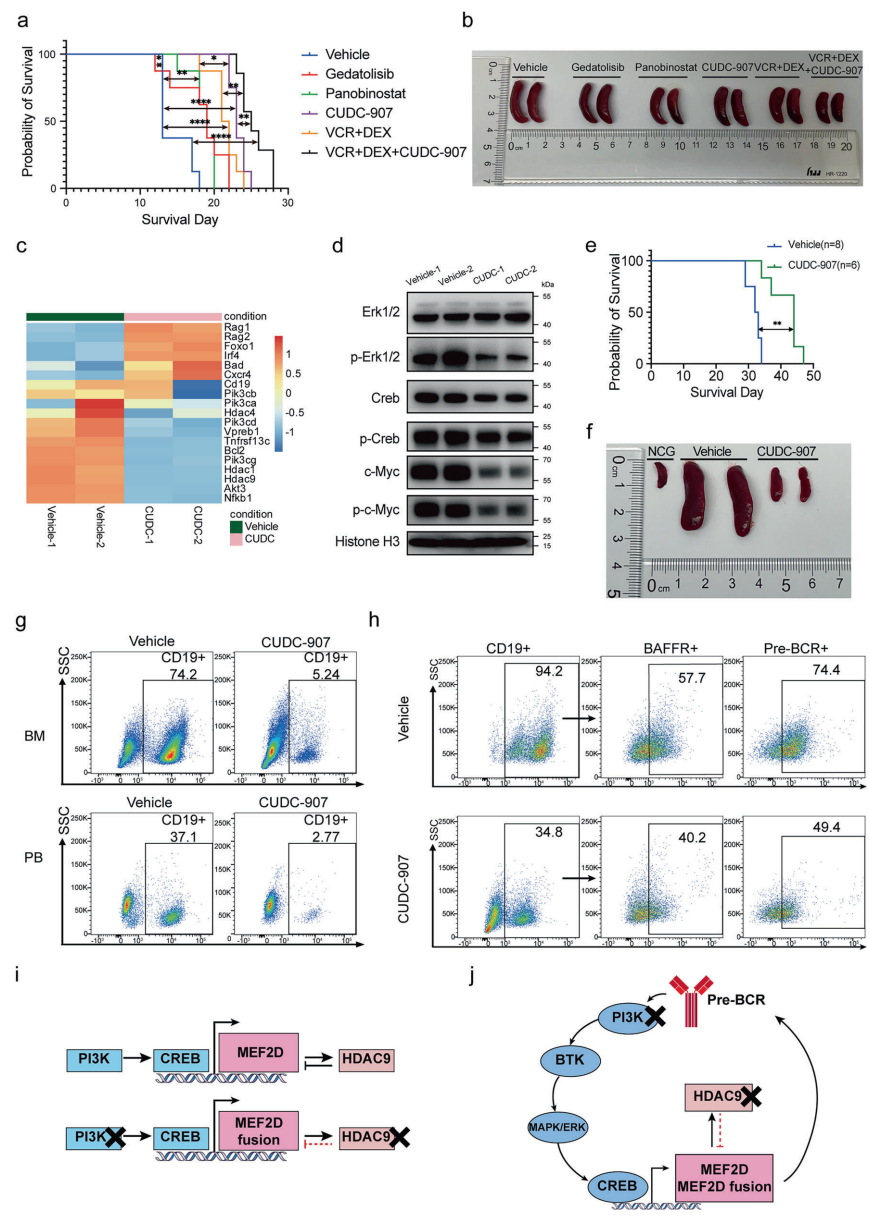
临床前验证
在MH/NRASG12D小鼠模型中,CUDC-907单药(100 mg/kg)疗效优于传统VCR+DEX方案(生存期延长40%),与化疗联用可实现近完全缓解。MB PDX模型显示该药物使CD19+白血病细胞在外周血中从37.1%降至2.77%,并显著缓解肝脾浸润。
这项研究的重要意义在于:首次阐明MEF2D融合通过"表观遗传失调(HDAC9)-信号通路激活(PI3K)"双重机制驱动白血病发生;临床级药物CUDC-907可同时纠正这两种异常,为这类难治性白血病提供即用型治疗方案;提出的双靶点协同抑制策略对类似融合基因驱动的肿瘤具有普适性参考价值。研究团队特别指出,由于约5%的pre-BCR+ BCP-ALL具有相似分子特征,该成果可能惠及更广泛患者群体。
 生物通微信公众号
生物通微信公众号
知名企业招聘