
-

生物通官微
陪你抓住生命科技
跳动的脉搏
PD-1/PD-L1抑制剂SCL-1通过上调lncRNA表达抑制三阴性乳腺癌生长的机制研究
【字体: 大 中 小 】 时间:2025年07月25日 来源:Scientific Reports 3.8
编辑推荐:
本研究针对三阴性乳腺癌(TNBC)免疫治疗响应率低的临床难题,开发了新型小分子PD-1/PD-L1抑制剂SCL-1。研究人员通过人源化MHC双敲除NOG小鼠模型证实,口服SCL-1可使MDA-MB231肿瘤体积缩小50%以上,其效果显著优于nivolumab和atezolizumab。RNA测序首次发现SCL-1能上调肿瘤特异性长链非编码RNA(lncRNA)表达,其中MALAT1和NEAT1等lncRNA衍生的HLA-A*02:01限制性表位肽具有CTL激活潜力。该研究为TNBC免疫治疗提供了新策略和潜在生物标志物。
在肿瘤免疫治疗领域,三阴性乳腺癌(TNBC)始终是块难啃的"硬骨头"。尽管PD-1/PD-L1抑制剂在黑色素瘤、非小细胞肺癌等领域大放异彩,但对TNBC的治疗效果却差强人意。这种恶性程度高、易转移的乳腺癌亚型,因其雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)均为阴性而得名,治疗手段极为有限。更令人头疼的是,即使采用新辅助化疗联合免疫检查点抑制剂(ICI)的治疗方案,患者的响应率仍不尽如人意。
日本静冈癌症中心研究所(Shizuoka Cancer Center Research Institute)的免疫治疗团队另辟蹊径,将目光投向小分子化合物开发。他们此前研发的SCL-1在12种同源小鼠肿瘤模型中展现出惊人效果,如今又在人源化动物模型上取得突破。这项发表在《Scientific Reports》的研究揭示,这种口服小分子不仅能强力抑制TNBC生长,还意外打开了lncRNA这个"潘多拉魔盒"——这些曾被视作基因组"暗物质"的长链非编码RNA,可能是激活抗癌免疫的关键钥匙。
研究人员采用多学科交叉的研究方法:通过人源化MHC双敲除NOG小鼠模型模拟人类免疫系统;利用流式细胞术分析肿瘤浸润淋巴细胞(TIL)亚群;采用RNA测序技术鉴定差异表达基因;结合NetMHCpan算法预测HLA-A02:01限制性表位肽;最后通过MHC稳定化实验验证lncRNA衍生肽段的免疫原性。所有实验均使用HLA-A02:01阳性的MDA-MB231细胞系及其PD-L1敲除克隆,并匹配健康供者外周血单个核细胞(PBMC)。
Cell proliferation assay
细胞毒性实验显示SCL-1对MDA-MB231细胞无明显杀伤作用(IC50>100μM),而对照化合物BMS202在9.1μM即显现毒性,证实SCL-1的抗肿瘤效应非直接细胞毒作用。
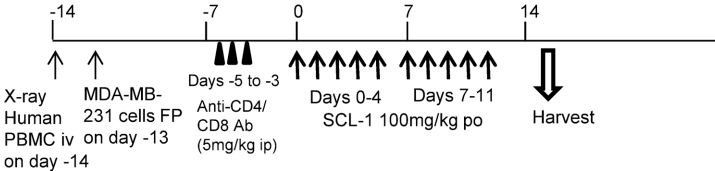
In vivo experiments using humanized MHC-dKO NOG mice
TIL analysis via flow cytometry
SCL-1使肿瘤内CD8+T细胞增加50%,CD19+B细胞增加2倍(表1)。免疫组化(Supplementary Fig.S2)显示SCL-1组肿瘤中CD8+T细胞广泛浸润。实时定量PCR检测到颗粒酶B(GZMB)、穿孔素(PRF1)等细胞毒性标志物及PD-1、TIM3等耗竭标志物表达均上调>1.5倍(图6),而CXCL12表达显著下调,提示肿瘤微环境结构改变。
RNA-seq of MDA-MB231 tumors treated with SCL-1
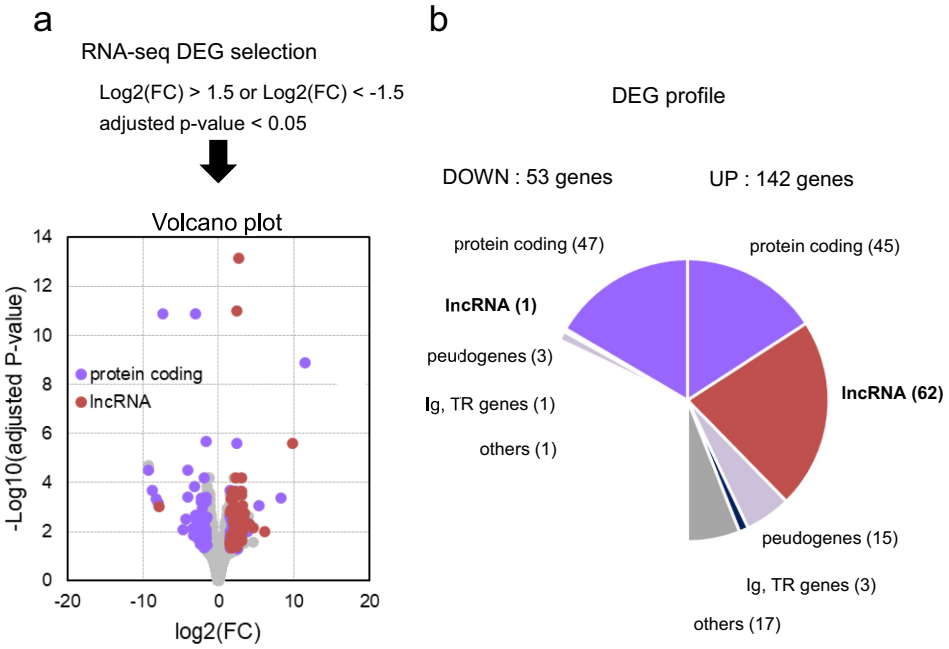
这项研究开创性地揭示了SCL-1的双重作用机制:一方面通过阻断PD-1/PD-L1通路激活效应T细胞;另一方面诱导lncRNA表达产生新抗原(neoantigen)。特别值得注意的是,PD-L1敲除细胞中未观察到这些lncRNA上调,暗示SCL-1可能存在独立于PD-1/PD-L1通路的"脱靶效应"。从转化医学角度看,MALAT1和NEAT1等lncRNA衍生的CTL表位为TNBC疫苗开发提供了新靶点,而其表达水平可能成为预测SCL-1疗效的生物标志物。这项研究不仅为TNBC免疫治疗提供了新武器,更开辟了通过调控lncRNA增强抗肿瘤免疫的新思路,具有重要的临床转化价值。
 生物通微信公众号
生物通微信公众号
知名企业招聘