
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:"移植物抗宿主病中的微生物组:两个生态系统的故事"
【字体: 大 中 小 】 时间:2025年07月26日 来源:Journal of Translational Medicine 6.1
编辑推荐:
这篇综述深入探讨了肠道微生物组在移植物抗宿主病(GVHD)中的关键作用,揭示了供受体微生物组(HSCT)的动态互作机制,重点分析了短链脂肪酸(SCFA)、调节性T细胞(Treg)等免疫调节通路,并评估了粪菌移植(FMT)等创新疗法的临床应用前景。
在造血干细胞移植(HSCT)前,患者的肠道微生物组已因化疗、放疗等治疗手段发生显著改变。白血病等血液系统恶性肿瘤本身就会导致微生物多样性降低,而化疗药物如高剂量方案可使厚壁菌门减少70%,同时使变形菌门增加15倍。这些变化通过破坏核苷酸代谢和黏膜修复通路,显著增加细菌易位风险。
放疗会加重黏膜损伤,减少对维持厌氧环境至关重要的梭菌目种群。广谱抗生素如氟喹诺酮类会进一步耗竭产丁酸盐的Blautia和Faecalibacterium等关键菌属,这些菌群产生的短链脂肪酸(SCFA)对调节性T细胞(Treg)分化和上皮稳态至关重要。抗真菌药物则可能抑制酵母菌,削弱Th17细胞介导的防御机制。
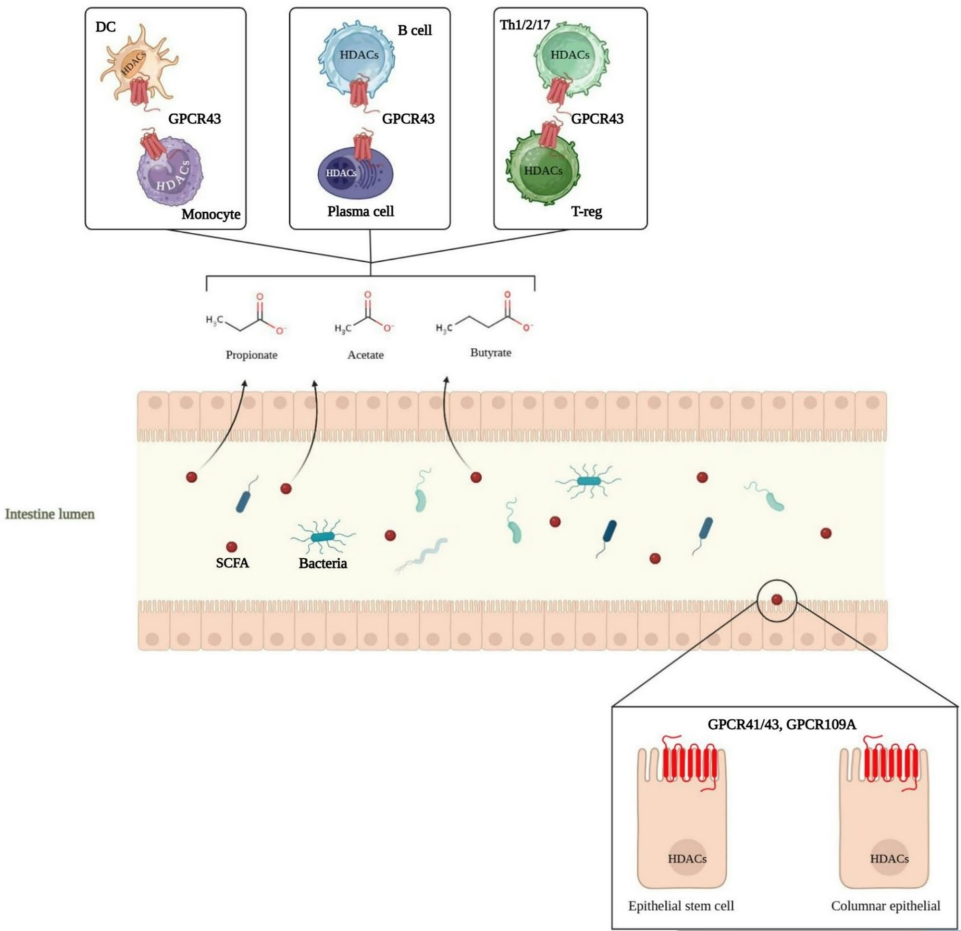
肠道微生物通过多种机制塑造免疫反应:拟杆菌属产生的多糖A(PSA)通过TLR2激活树突状细胞(DC),诱导IL-10产生;而大肠杆菌的脂多糖(LPS)则通过TLR4/NLRP3/IL-1β通路促进中性粒细胞浸润。梭菌属发酵膳食纤维产生的丁酸盐通过抑制组蛋白去乙酰化酶(HDAC),增强紧密连接蛋白表达,促进结肠Foxp3+ Treg扩增。
在HSCT背景下,微生物多样性降低与促炎细胞因子(如IL-6、TNF-α)水平升高相关。肠球菌优势菌群会使Treg/Th17比例降低40%,这与CD4+ T细胞中组蛋白H3超乙酰化有关。双歧杆菌等有益菌则通过吲哚酸激活芳香烃受体(AhR),增强肠道屏障功能。
移植过程中,供体造血干细胞产品并非无菌,可能含有肠球菌和葡萄球菌等微生物成分。在受体免疫抑制和黏膜损伤的环境下,这些微生物可能定植并影响预后。动物研究表明,供体梭菌目菌种可通过产生丁酸盐抑制促炎T细胞反应,而肠球菌则会加剧黏膜损伤。
生命早期微生物-免疫系统的互作对GVHD发展有深远影响。新生儿期丰富的免疫抑制性红细胞和高IL-10表达为微生物定植提供了耐受环境。断奶后建立的梭菌属通过SCFAs促进RORγt+ Treg分化,这些细胞终身调节肠道免疫平衡。
SCFAs(1-6碳脂肪酸)通过G蛋白偶联受体(GPCR41/43/109A)发挥作用:丁酸盐主要被肠上皮吸收,丙酸盐被肝脏摄取,醋酸盐则进入外周组织。这些代谢物通过抑制HDAC调节基因表达,如丁酸盐通过HDAC3/6调节NF-κB亚基p65的乙酰化,影响促炎基因转录。
临床研究显示:
值得注意的是,移植前微生物组特征对GVHD风险具有预测价值(AUC≈0.67)。个性化干预如特定菌株益生菌或供体微生物组筛选可能改善预后。
 生物通微信公众号
生物通微信公众号
知名企业招聘