
-

生物通官微
陪你抓住生命科技
跳动的脉搏
长期运动通过下调EAF2-p53-TSP-1通路增强阿尔茨海默病模型小鼠脑膜淋巴管可塑性及引流功能
【字体: 大 中 小 】 时间:2025年07月26日 来源:Translational Neurodegeneration 10.8
编辑推荐:
本研究针对阿尔茨海默病(AD)中脑膜淋巴管功能损伤的机制展开探索,发现星形胶质细胞来源的血小板反应蛋白-1(TSP-1)通过CD36/CD47信号通路抑制淋巴管生成和连接可塑性。南京医科大学团队通过跑步机运动干预和基因敲降实验证实,长期运动通过下调EAF2-p53-TSP-1通路改善5xFAD小鼠脑膜淋巴管引流功能,减少Aβ沉积和胶质细胞活化,为AD的非药物干预提供新靶点。该成果发表于《Translational Neurodegeneration》。
在神经退行性疾病研究领域,阿尔茨海默病(AD)的病理机制一直是科学家们攻坚的重点。随着近年脑膜淋巴管系统的发现,这个曾经被忽视的"脑内排污系统"成为研究热点。然而,在AD病程中,脑膜淋巴管为何会出现功能障碍?能否通过非药物手段改善其功能?这些问题成为亟待解决的科学难题。
南京医科大学神经退行性疾病重点实验室的研究团队在《Translational Neurodegeneration》发表的最新研究给出了重要答案。他们发现,在AD模型小鼠中,活化的星形胶质细胞会大量分泌血小板反应蛋白-1(TSP-1),这种分子如同"淋巴管生长抑制剂",通过结合淋巴管内皮细胞表面的CD36和CD47受体,不仅阻碍新淋巴管形成,还破坏原有的管状结构。更令人振奋的是,研究人员证实长期跑步机运动能显著改善这一状况,其机制与下调EAF2-p53-TSP-1信号通路密切相关。
研究采用了多学科交叉的技术路线:通过免疫荧光染色和双光子活体成像观察脑膜淋巴管形态和功能;利用RNA测序筛选关键调控因子;建立星形胶质细胞特异性基因敲降的AAV载体;开展体外淋巴管内皮细胞培养和管形成实验;结合行为学测试评估认知功能改善效果。所有实验均在6.5月龄5xFAD转基因小鼠及其野生型对照中进行。
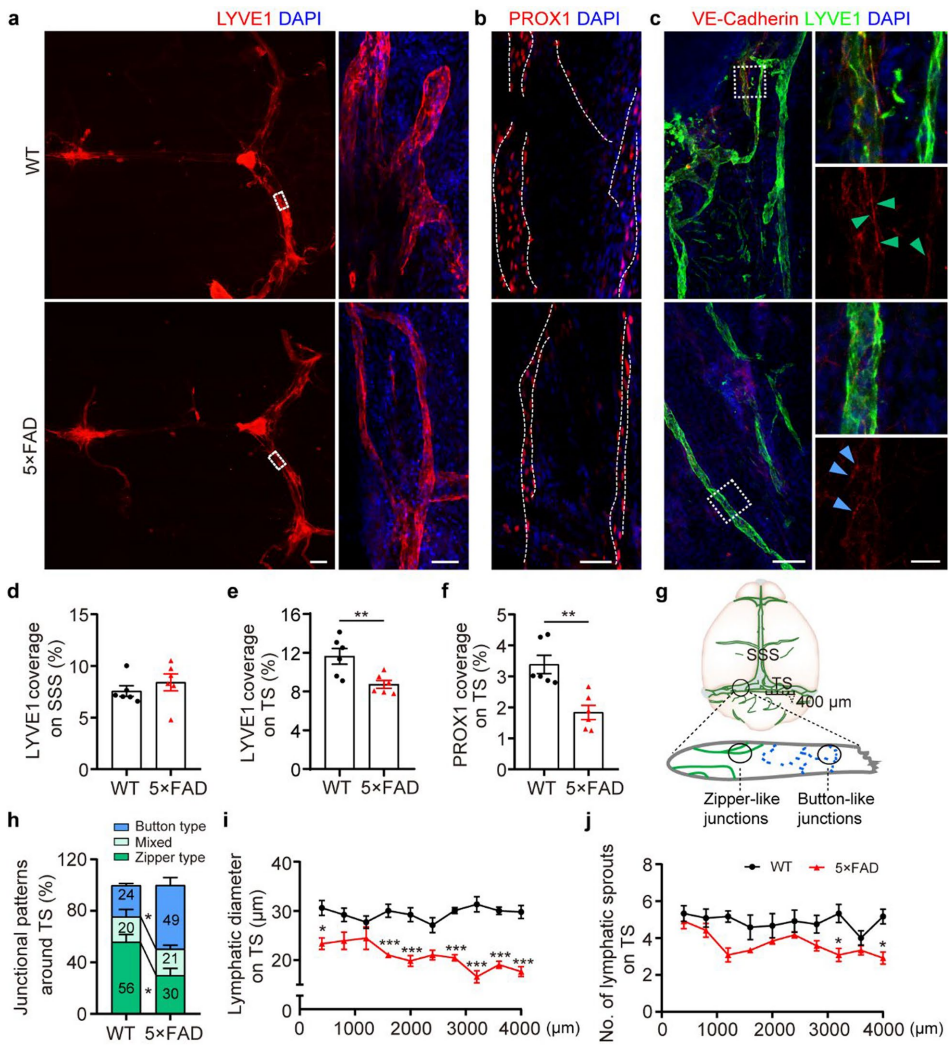
脑膜淋巴管结构损伤是AD的重要特征
研究发现5xFAD小鼠的脑膜淋巴管覆盖面积减少33%,淋巴管内皮细胞间的"拉链样连接"(zipper-like junction)减少而"纽扣样连接"(button-like junction)增加,这种结构变化直接影响了淋巴引流效率。
星形胶质细胞是TSP-1的主要来源
通过RNA测序和免疫荧光定位,研究人员发现活化的星形胶质细胞高表达TSP-1,其水平随Aβ刺激浓度增加而升高。ELISA检测显示AD小鼠脑脊液中TSP-1含量是对照组的2.1倍。
TSP-1的双重抑制作用机制
体外实验证实,TSP-1通过CD36抑制淋巴管新生,同时通过CD47破坏VE-cadherin形成的连续连接。当同时存在低浓度Aβ(2μmol/L)和TSP-1(100 ng/mL)时,两者产生协同抑制效应。
运动干预重塑淋巴管网络
30天的跑步机训练使AD小鼠脑膜淋巴管直径增加28%,引流效率提升。活体成像显示运动组Aβ-555示踪剂在横窦区域的清除速度加快,颈深淋巴结中Aβ和GFAP信号增强。
EAF2-p53-TSP-1通路是关键靶点
运动通过下调星形胶质细胞中EAF2的表达,减少其与p53的结合,最终降低TSP-1的产生。特异性敲降Eaf2可产生与运动类似的保护效果,包括减少42%的Aβ斑块和改善认知功能。
这项研究首次揭示了运动改善AD病理的新机制——通过调节脑膜淋巴管可塑性促进Aβ清除。EAF2-p53-TSP-1通路的发现为AD治疗提供了潜在靶点,而运动干预方案的建立则具有重要的转化医学价值。特别值得注意的是,研究中采用的跑步机训练方案(每天两次,坡度10°,速度递增)可直接转化为临床康复指导。该成果不仅为理解神经-淋巴相互作用提供了新视角,也为开发AD的非药物干预策略奠定了理论基础。


 生物通微信公众号
生物通微信公众号
知名企业招聘