
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:释放运动潜力:靶向炎症小体激活攻克心血管疾病
【字体: 大 中 小 】 时间:2025年07月27日 来源:European Journal of Medical Research 2.8
编辑推荐:
这篇综述深入探讨了运动通过调控NLRP3炎症小体(inflammasome)通路改善心血管疾病(CVD)的分子机制。文章系统阐述了炎症小体激活与心肌梗死(MI)、动脉粥样硬化(AS)等疾病的关联,提出运动可通过抑制TXNIP/NLRP3/caspase-1/IL-1β轴、增强一氧化氮(NO)生物利用度等途径减轻血管内皮细胞焦亡(pyroptosis),为心血管疾病的非药物干预提供新策略。
心血管疾病(CVD)是全球死亡的首要原因,其发展涉及慢性炎症的持续激活。研究表明,促炎因子如IL-1β和IL-18通过激活NF-κB信号通路,加剧内皮功能障碍和心肌纤维化。急性心肌梗死(AMI)后,中性粒细胞和巨噬细胞通过S100A8/9-TLR4通路释放IL-1β,触发心肌炎症级联反应。而衰老相关"炎症衰老"(inflammaging)现象中,线粒体DNA泄漏和异常免疫细胞极化(如Th17增多)进一步加速心脏重构。
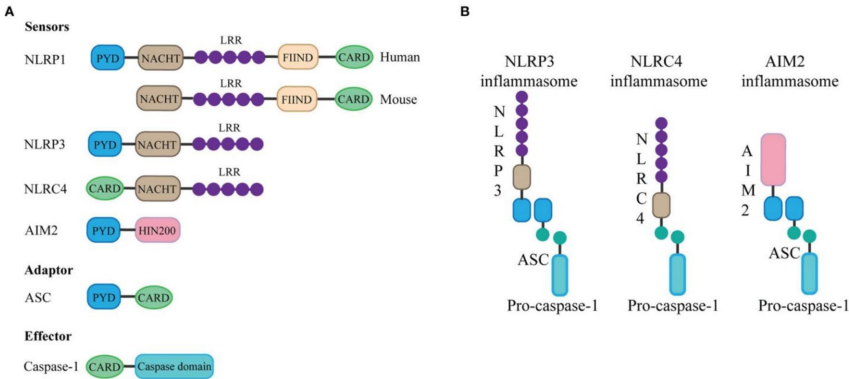
NLRP3炎症小体由NLRP3受体、ASC适配蛋白和caspase-1效应蛋白组成,其激活需经历"启动"(NF-κB介导的转录上调)和"触发"(K+外流/活性氧ROS积累)两阶段。激活后切割GSDMD形成膜孔,导致IL-1β分泌和细胞焦亡。在动脉粥样硬化中,氧化低密度脂蛋白(ox-LDL)通过抑制TET2酶激活NLRP3,而胆固醇晶体则通过溶酶体破裂触发该通路。动物实验显示,NLRP3基因敲除小鼠的冠状动脉内皮功能显著改善。
规律运动通过多途径抑制炎症小体:
临床数据显示,12周中等强度运动使心衰患者ASC甲基化水平升高,血清IL-1β降低29%。而高强度间歇训练(HIIT)能减少心肌梗死大鼠53%的梗死面积,其机制与抑制Drp1介导的线粒体分裂相关。
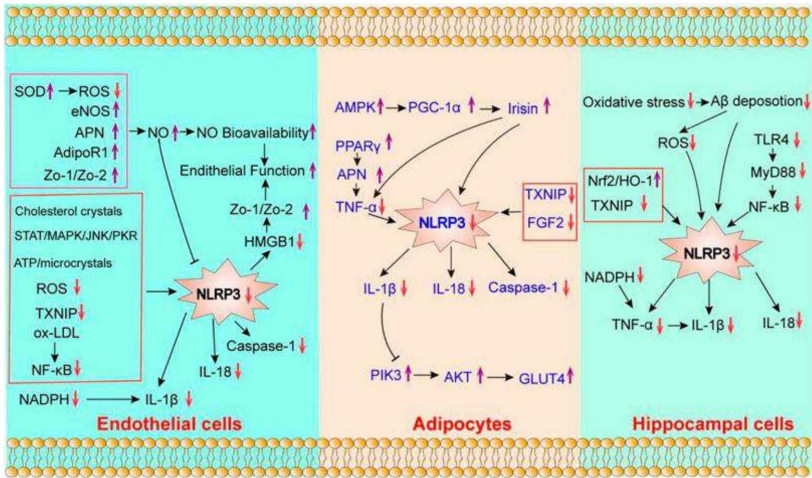
靶向NLRP3的小分子抑制剂(如MCC950)在动物模型中显示抗纤维化效果,而运动训练与FGF21联合可协同抑制主动脉焦亡。未来研究需优化运动处方参数(强度/时长),并探索表观遗传调控(如m6A修饰)在运动获益中的作用。当前证据表明,每周150分钟中等强度运动可作为心血管疾病的一级预防策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘