
-

生物通官微
陪你抓住生命科技
跳动的脉搏
脑膜肥大细胞通过调控脑-硬脑膜界面ACE点及脑脊液动力学抵御中枢神经系统感染
【字体: 大 中 小 】 时间:2025年07月27日 来源:Cell 45.5
编辑推荐:
本研究由华盛顿大学圣路易斯分校团队揭示,硬脑膜肥大细胞通过调控蛛网膜袖套出口(ACE)点的脑脊液(CSF)动力学,形成中枢神经系统(CNS)免疫防御新机制。研究人员发现肥大细胞脱颗粒释放的组胺可诱导桥静脉扩张,改变CSF流动路径,同时招募中性粒细胞共同阻止病原体经ACE点侵入脑实质。该发现为脑膜炎治疗提供了以肥大细胞为靶点的新型干预策略,发表于《Cell》杂志。
在中枢神经系统防御领域,一个长期存在的谜题是:病原体如何突破血脑屏障(BBB)引发脑膜炎?传统研究多聚焦于脑血管内皮细胞的屏障功能,却忽视了脑膜特殊解剖结构的关键作用。华盛顿大学圣路易斯分校(Washington University in St. Louis)的Tornike Mamuladze和Jonathan Kipnis团队在《Cell》发表的研究,首次揭示了硬脑膜肥大细胞(mast cells)通过调控脑-硬脑膜界面的蛛网膜袖套出口(arachnoid cuff exit, ACE)点,成为抵御病原体入侵的"守门人"。
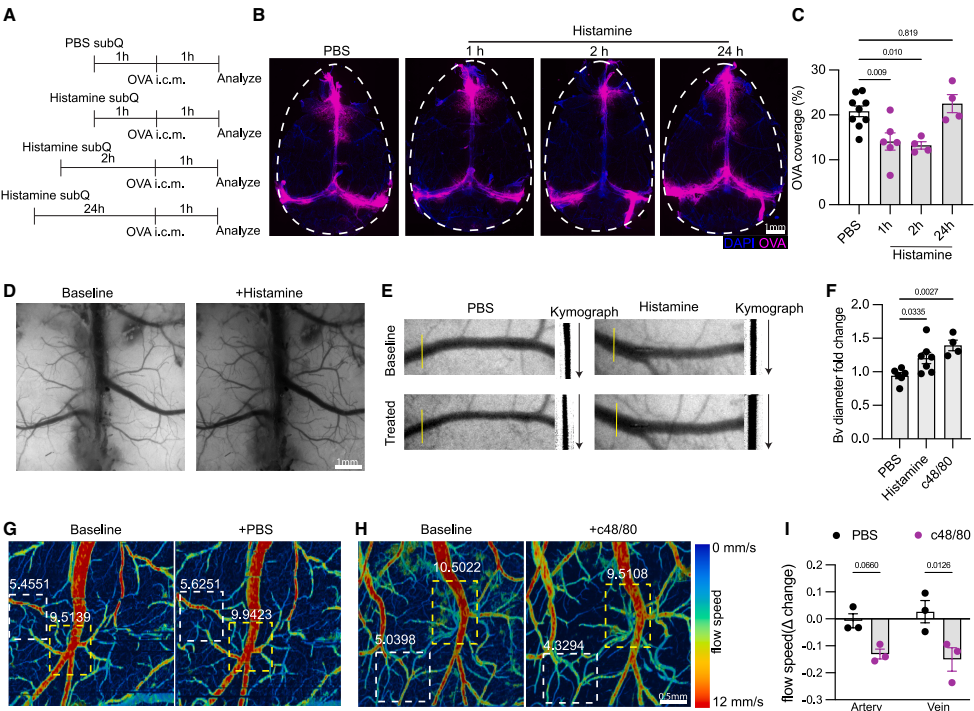
研究采用多学科交叉技术:1)双光子显微成像技术实时观测脑脊液(CSF)流动动力学;2)光声显微技术定量分析桥静脉(bridging veins)血管舒缩状态;3)条件性基因敲除小鼠模型(Mrgprb2-Cre/iDTR)实现硬脑膜肥大细胞特异性剔除;4)流式细胞术分析免疫细胞浸润特征;5)细菌负荷定量分析结合荧光标记病原体示踪技术。
【Meningeal mast cells control CSF flow dynamics at ACE points】
研究团队发现硬脑膜肥大细胞富集于ACE点周围,通过单细胞RNA测序证实其高表达组氨酸脱羧酶(Hdc)和Mrgprb2受体。使用化合物48/80激活肥大细胞后,CSF向硬脑膜的流出显著减少,这种效应在肥大细胞缺陷型KitW-sh小鼠中消失。通过双光子显微成像证实,该过程伴随桥静脉周围间隙的缩小。
【Mast-cell-derived histamine induces bridging-vein vasodilation to control CSF flow】
机制研究表明,肥大细胞释放的组胺通过H1/H2受体-一氧化氮(NO)通路诱导桥静脉扩张。光声显微技术显示,该过程导致脑血流速度下降但氧饱和度不变。值得注意的是,组胺灌注可模拟肥大细胞激活的生理效应,而受体拮抗剂西替利嗪(cetirizine)能逆转CSF流动障碍。
【Meningeal mast cell activation as a host defense against meningitis and pathogen access to the brain】
在B族链球菌(GBS)和肺炎链球菌感染模型中,病原体优先聚集于ACE点。肥大细胞通过Mrgprb2受体直接识别细菌群体感应分子CSP-1,触发脱颗粒反应。局部肥大细胞剔除导致脑内细菌负荷增加3倍,而预先激活肥大细胞则显著降低感染程度。组胺替代治疗可部分恢复防御功能,但完全保护需要依赖中性粒细胞招募。
该研究建立了"肥大细胞-ACE点-CSF动力学"三位一体的中枢防御新范式:1)解剖学上揭示ACE点作为脑-外周交流的关键门户;2)机制上阐明组胺介导的血管动力学调控;3)临床上为脑膜炎防治提供新靶点。特别值得注意的是,这种防御机制具有时空特异性——急性激活可封闭感染通道,但慢性激活可能影响β淀粉样蛋白(Aβ)清除,这为神经退行性疾病研究开辟了新视角。研究采用的局部药物递送策略(头皮皮下注射)也为中枢靶向治疗提供了技术参考。

 生物通微信公众号
生物通微信公众号
知名企业招聘