
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:肠道微生物组与胃癌:微生物相互作用及治疗潜力
【字体: 大 中 小 】 时间:2025年07月28日 来源:Gut Pathogens 4.4
编辑推荐:
这篇综述深入探讨了肠道微生物组(Gut Microbiota)在胃癌(GC)发生发展中的关键作用,重点分析了幽门螺杆菌(H. pylori)及其他微生物通过基因毒性、慢性炎症和代谢重编程等机制促进肿瘤微环境(TME)重塑的过程,并展望了基于微生物组的诊断标志物和靶向治疗策略(如噬菌体疗法、工程菌干预等)的应用前景。
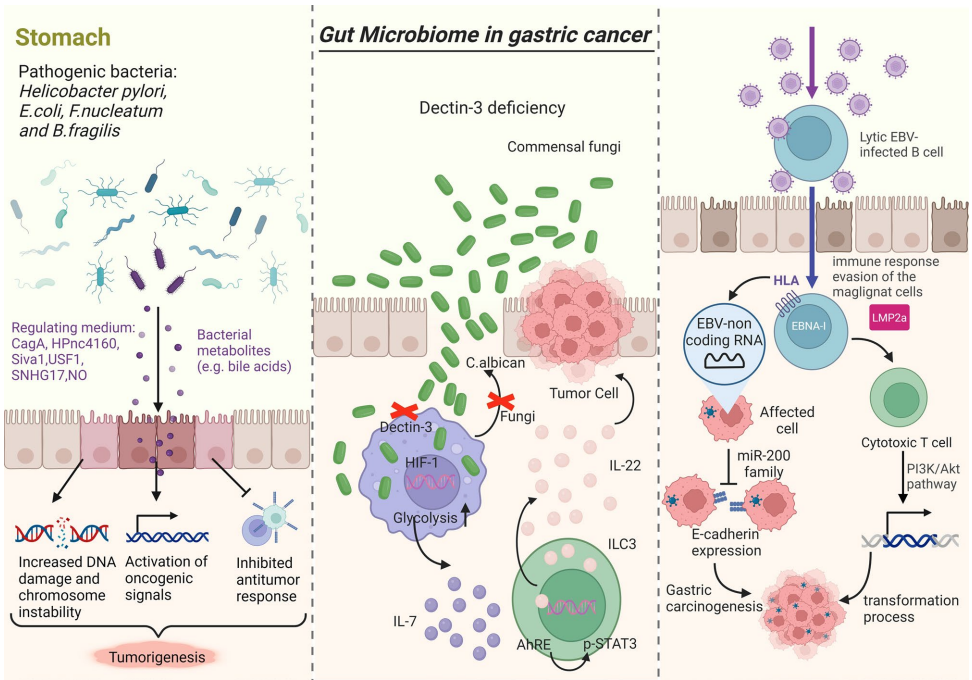
胃癌(GC)是全球癌症相关死亡的第五大原因,年新增病例约110万例。尽管治疗手段进步,晚期患者预后仍不乐观。近年研究发现,肠道微生物组通过调控免疫应答、代谢产物和表观遗传修饰,在GC发生中扮演核心角色。其中幽门螺杆菌(H. pylori)感染是明确致癌因素,但其他微生物如链球菌(Streptococcus)、乳酸菌(Lactobacillus)等亦通过"Hp启动-非Hp加速"级联反应参与癌变进程。
H. pylori的致癌作用
H. pylori通过分泌细胞毒素相关蛋白(CagA)和空泡毒素(VacA)激活Wnt/β-catenin、PI3K/Akt等致癌信号通路。其小RNA分子Hpnc4160可抑制自噬,促进恶性转化。长期感染导致胃酸减少,使产亚硝胺细菌增殖,进一步诱发DNA损伤。值得注意的是,Hp在癌组织中丰度反而降低,提示其更倾向定植于健康黏膜。
其他细菌的协同作用
胃癌患者肠道中普雷沃菌(Prevotella)、韦荣球菌(Veillonella)显著富集,而疣微菌门(Verrucomicrobia)减少。具核梭杆菌(F. nucleatum)通过激活STAT3/Th17免疫反应促进肿瘤生长,而大肠杆菌(E. coli)产生的基因毒素可直接损伤DNA。真菌群落分析显示,癌组织中子囊菌门(Ascomycetes)过度增殖,可能与黏膜屏障破坏相关。
免疫细胞重编程
H. pylori感染可诱导胃上皮细胞表达PD-L1,帮助肿瘤逃避免疫监视。菌群代谢产物短链脂肪酸(SCFAs)能促进调节性T细胞分化,而次级胆汁酸则通过激活YAP/TAZ通路影响干细胞功能。细菌外膜囊泡(BEVs)携带的热休克蛋白60(HSP60)可促进M2型肿瘤相关巨噬细胞(TAMs)极化,形成免疫抑制微环境。
非编码RNA的桥梁作用
H. pylori阳性患者中miR-18a-3p和miR-4286显著高表达,可能通过调控BZRAP1基因影响癌变进程。EB病毒(EBV)编码的非编码RNA能抑制miR-200家族,导致上皮-间质转化(EMT)关键蛋白E-钙黏蛋白表达下降。
诊断标志物
胃癌特异性甲基化标记物如USF1基因可用于风险分层。粪便BEVs中厚壁菌门(Firmicutes)丰度变化与化疗敏感性相关,而阿克曼菌(Akkermansia)的富集可预测PD-1抑制剂疗效。
治疗策略革新
当前微生物干预面临菌株特异性、地域差异性和安全性等挑战。未来需开展多组学研究,阐明微生物-宿主互作的分子时钟机制,开发个性化菌群调控方案。值得注意的是,抗生素使用可能破坏菌群平衡,反而降低免疫治疗响应率,提示需要精准的菌群编辑策略。
 生物通微信公众号
生物通微信公众号
知名企业招聘