
-

生物通官微
陪你抓住生命科技
跳动的脉搏
双重靶向转铁蛋白受体和CD98hc增强大分子药物脑部递送效率的创新策略
【字体: 大 中 小 】 时间:2025年07月28日 来源:Cell Reports 7.5
编辑推荐:
本研究针对血脑屏障(BBB)阻碍生物大分子药物递送的难题,开发了同时靶向转铁蛋白受体(TfR)和CD98hc的双重运输载体(dual TV)。通过工程化改造人源IgG1 Fc片段,研究人员构建了能同时结合两种受体的双特异性分子,证明其脑部药物浓度较单靶点载体提升2.25倍以上。该平台通过调节受体亲和力可精确控制药物在脑部的分布动力学,其中CD98hc结合可减少TfR介导的神经元内化,显著延长药物滞留时间。这项发表于《Cell Reports》的研究为神经退行性疾病和中枢神经系统肿瘤的治疗提供了突破性的递送策略。
血脑屏障如同大脑的"海关",严格限制着治疗药物的进入。这一生理屏障虽然保护了中枢神经系统免受有害物质侵袭,却也使超过98%的大分子药物被拒之门外。阿尔茨海默病、帕金森病等神经退行性疾病,以及脑肿瘤的治疗因此面临巨大挑战。传统药物主要通过脑脊液缓慢渗透,难以在脑实质达到有效浓度。近年来,科学家发现转铁蛋白受体(TfR)和CD98hc这两种在血脑屏障内皮细胞高表达的蛋白质,可作为"特洛伊木马"帮助药物入脑。但单靶点策略各有局限:TfR介导的递送虽快速但代谢快,CD98hc途径虽持久但效率低。
Denali Therapeutics, Inc.的研究团队创新性地将两种策略合二为一。他们发表在《Cell Reports》的研究中,通过工程化改造人源IgG1 Fc片段,构建了能同时靶向TfR和CD98hc的双重运输载体(dual TV)。这种双特异性分子采用"knob-into-hole"技术,在一个Fc片段上分别整合TfR和CD98hc结合位点。研究显示,dual TV不仅保留了两种受体的独立结合能力,还产生了协同效应——当TfR像"特快专列"将药物快速送入大脑时,CD98hc则像"智能停车系统"减少药物被神经元过快清除,从而显著提升脑部药物浓度和滞留时间。
关键技术包括:表面等离子共振(SPR)测定受体亲和力、流式细胞术分析细胞结合特性、免疫组化三维重建脑区分布、数学建模预测药代动力学。使用基因改造的TfRmu/hu; CD98hcmu/hu双敲入小鼠模型,通过静脉注射25 mg/kg剂量系统评估了9种不同亲和力组合的双靶点载体。
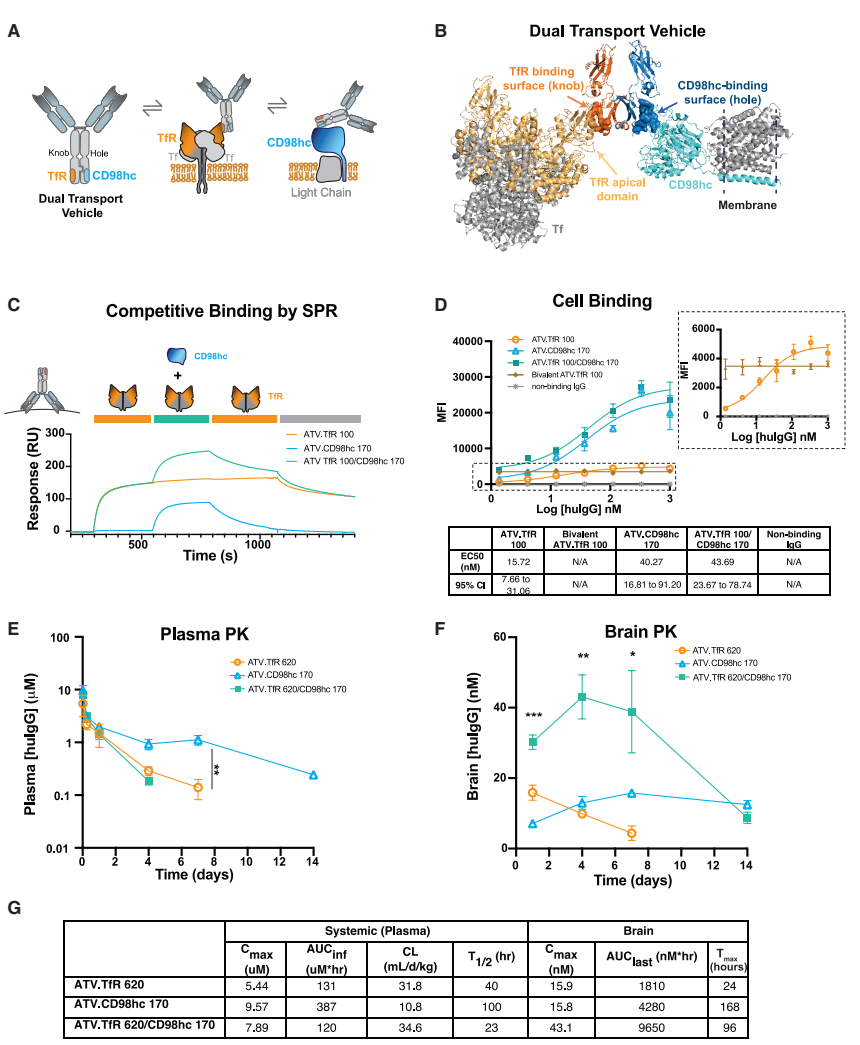
工程化双靶向载体的结合特性
通过结构建模证实,dual TV可同时结合TfR和CD98hc的胞外结构域。流式细胞术显示,在HEK293T细胞表面,dual TV的CD98hc结合能力与单靶点载体相当,但未观察到明显的协同结合效应。这表明双靶点协同作用主要发生在转运过程中,而非初始结合阶段。
显著增强的脑部暴露
药代动力学数据显示,具有中等TfR亲和力(KD=620 nM)和强CD98hc亲和力(KD=170 nM)的dual TV,其脑部Cmax和AUC较单靶点载体提高2.25倍以上。特别值得注意的是,弱化TfR亲和力(KD=2,500 nM)配合强CD98hc结合的变体,能维持脑部药物浓度>20 nM达14天之久,创造了单靶点载体无法实现的持久暴露。
可调控的脑部分布动力学
通过系统调节9种不同亲和力组合发现:强TfR亲和力驱动快速入脑(Tmax=1天),但伴随快速代谢;而强CD98hc亲和力则带来缓慢但持久的脑部滞留(Tmax=7天)。这种"调速"能力使dual TV能根据不同治疗需求定制暴露曲线——需要快速起效时增强TfR结合,需长效作用时则强化CD98hc结合。
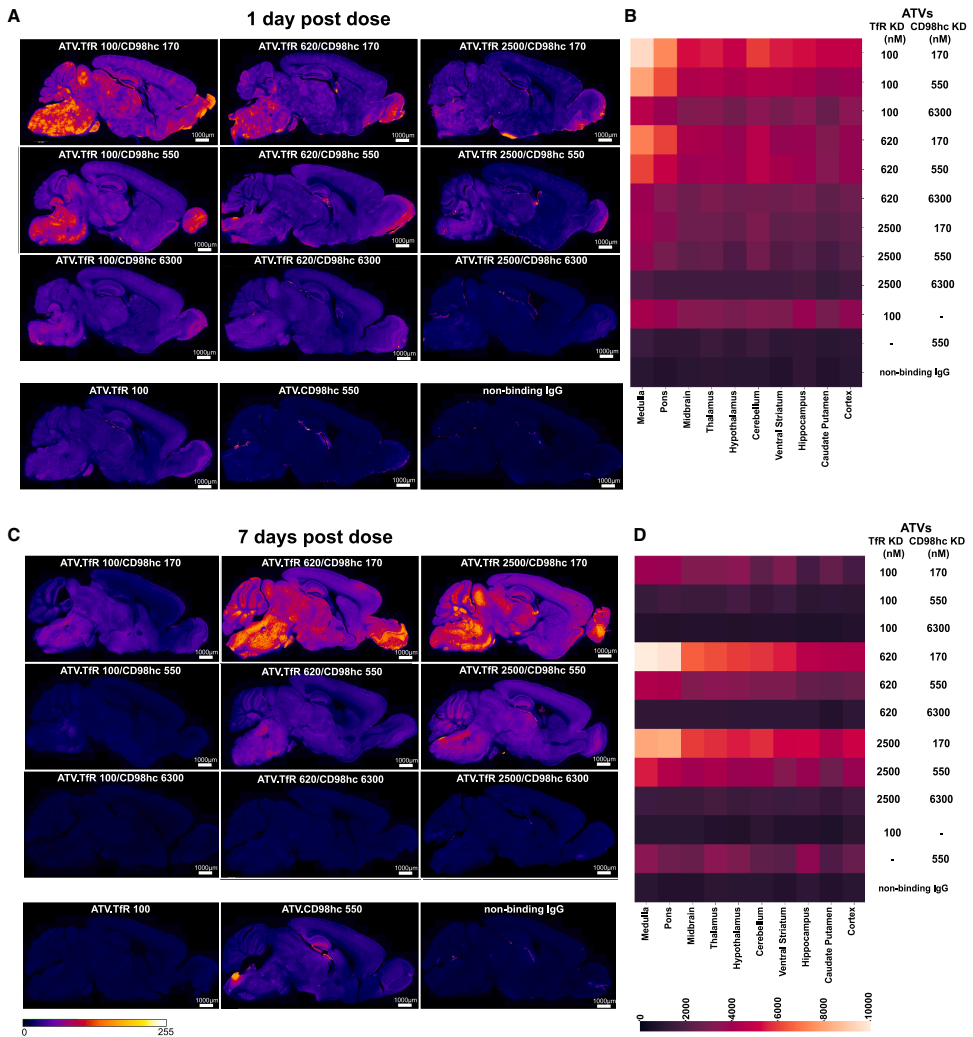
细胞特异性分布的重编程
高分辨率共聚焦显微镜揭示,CD98hc结合能剂量依赖性地减少TfR介导的神经元内化。即使弱CD98hc亲和力(KD=6,300 nM)也能显著降低药物在NeuN+神经元中的分布,转而增加在AQP4+星形胶质细胞突起中的滞留。这种细胞分布的重定向可能是dual TV延长脑部暴露的关键机制——通过减少神经元的高代谢活性区分布,降低药物清除速率。
组织分布的特征
在外周器官中,TfR亲和力主导骨髓分布,CD98hc亲和力调控肾脏蓄积。有趣的是,双靶点载体在脑干区域(如脑桥和延髓)表现出相对于单靶点载体的富集趋势,这可能为特定脑区疾病的靶向治疗提供线索。
这项研究开创了BBB穿越技术的新范式。dual TV平台通过巧妙整合两种受体途径的优势,不仅突破性地提高了脑部药物浓度,还首次实现了对药物脑内分布动力学的精确调控。其重要意义体现在三方面:首先,为抗体、酶替代疗法等大分子药物提供了通用递送平台;其次,通过调节亲和力可定制适合不同疾病的暴露特征——如快速清除的TfR优势型可能适合急性干预,而持久滞留的CD98hc优势型则适合慢性病管理;最重要的是,该研究揭示的"减少神经元内化以延长暴露"机制,为后续优化提供了明确方向。随着阿尔茨海默病抗体疗法等需要长期维持脑部药物浓度的需求日益增长,这种双靶点策略有望成为突破治疗瓶颈的关键技术。