
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:人工智能驱动的病理组学在肝细胞癌中的应用:当前进展、挑战与展望
【字体: 大 中 小 】 时间:2025年07月30日 来源:Discover Oncology 2.8
编辑推荐:
这篇综述系统阐述了人工智能(AI)驱动的病理组学(Pathomics)在肝细胞癌(HCC)诊断与预后中的变革性潜力。通过深度学习(DL)和机器学习(ML)技术,病理组学能从全切片图像(WSIs)中提取高通量特征,实现肿瘤异质性可视化,辅助MVI检测、病理分级及生存预测。尽管面临数据异质性、模型可解释性等挑战,整合多模态数据与病理基础模型(PFMs)的发展将推动个性化HCC诊疗。
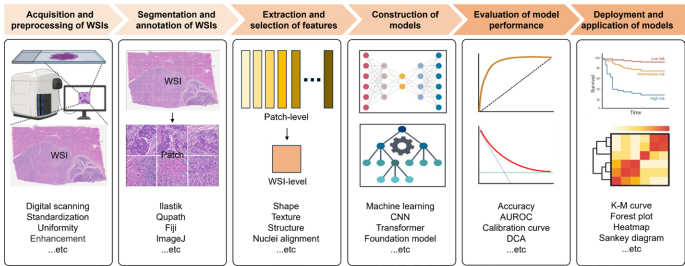
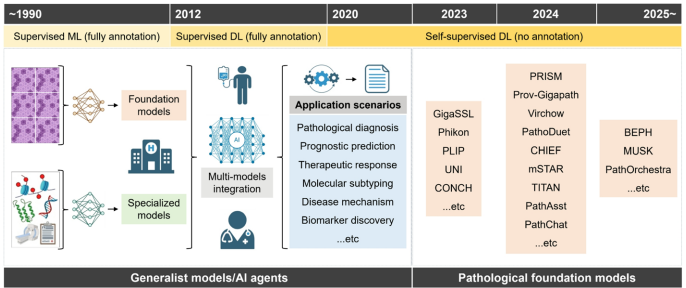
病理组学工作流程涵盖全切片图像(WSI)的获取与预处理、区域分割与标注、特征提取与筛选、模型构建及临床部署。如图1所示,通过卷积神经网络(CNN)或视觉Transformer(ViT)架构,AI能分析HCC组织中的细胞形态、核质比等特征,结合多实例学习(MIL)机制聚焦关键区域。新兴的病理基础模型(PFMs)通过自监督学习降低标注需求,为开发垂直领域专用模型提供支撑。
在肿瘤识别方面,Liao等开发的CNN模型实现正常与肿瘤组织分类AUROC达1.0。组织学分类中,Cheng团队的HnAIM模型对7类肝结节病变的鉴别准确率达93.5%。针对微血管侵犯(MVI),Zhang等开发的MVI-AIDM模型检测率(70.85%)显著高于病理医师(64.13%, P<0.001),并能量化MVI空间分布。这些突破显著提升了诊断效率与一致性。
病理组学可预测基因标志物如EZH2过表达(AUROC=0.815)及免疫特征。Laurent-Bellue等通过DL识别MTM亚型等高风险病理架构,准确率达82.3%。在生存预测方面,Saillard的深度学习模型C-index达0.78,优于传统临床分期。多模态融合成为趋势,Yu开发的放射-病理组学模型预测VETC模式的AUROC达0.79,显著提升复发预测效能。
数据异质性、算法偏见和伦理规范是主要瓶颈。解决方案包括:建立国际WSI标注联盟,采用联邦学习实现隐私保护下的多中心协作;开发定量可解释框架,如将Grad-CAM热图与基因通路关联;遵循SPIRIT-AI等指南完善监管流程。未来需推进前瞻性多中心研究,构建符合FDA/EMA标准的医疗AI平台,最终实现从"工具型"到"认知型"病理助手的进化。
 生物通微信公众号
生物通微信公众号
知名企业招聘