
-

生物通官微
陪你抓住生命科技
跳动的脉搏
造血组织中G蛋白偶联受体68缺失通过抑制细胞凋亡增强衰老期长期造血干细胞功能
【字体: 大 中 小 】 时间:2025年07月30日 来源:Stem Cell Research & Therapy 7.1
编辑推荐:
本研究针对G蛋白偶联受体68(GPR68)在造血干细胞(HSC)衰老过程中的调控机制展开。研究人员通过构建造血组织特异性敲除Gpr68的小鼠模型(Gpr68flox/flox;Vav-cre+),发现GPR68缺失可抑制Ca2+/Caspase凋亡通路,显著增强衰老期长期造血干细胞(LT-HSC)功能,同时改善红细胞参数。该研究为衰老相关造血功能障碍的干预提供了新靶点,发表于《Stem Cell Research》。
造血干细胞(HSC)是维持终身造血功能的核心,其衰老会导致贫血、免疫衰退等年龄相关疾病。尽管已知HSC依赖糖酵解维持静息状态,但微环境酸化产物如何调控HSC功能仍是未解之谜。G蛋白偶联受体68(GPR68)作为质子感应受体,在长期造血干细胞(LT-HSC)中高表达,但其生理功能尚未明确。温州医科大学附属第一医院的研究团队通过精巧的基因工程和功能实验,揭示了GPR68通过钙离子(Ca2+)信号调控HSC衰老的新机制,研究成果发表在《Stem Cell Research》。
研究采用造血组织特异性敲除(Vav-cre介导)和竞争性骨髓移植(cBMT)等关键技术,结合流式细胞术、钙离子检测和凋亡分析等方法。通过构建Gpr68flox/flox;Vav-cre+小鼠模型,系统评估了年轻(2月龄)和中年(10-13月龄)小鼠的造血功能差异,并利用老年野生型(18月龄)小鼠验证自然衰老过程中GPR68的表达变化。
背景
研究发现GPR68在LT-HSC中特异性高表达,但全身敲除小鼠未表现明显表型,提示可能存在代偿机制。通过分析衰老数据库Aging Altas,发现GPR68在衰老白细胞中表达下降,暗示其与造血衰老存在特殊关联。
结果
造血稳态维持:年轻和中年的Gpr68敲除小鼠仅显示巨核红系祖细胞(MEP)轻度增加,其他造血干细胞和祖细胞(HSPC)亚群数量无变化。

功能增强:竞争性移植实验显示,中年敲除小鼠的LT-HSC贡献率显著提高,二次移植后供体嵌合率增加2倍,证实GPR68缺失增强衰老HSC功能。
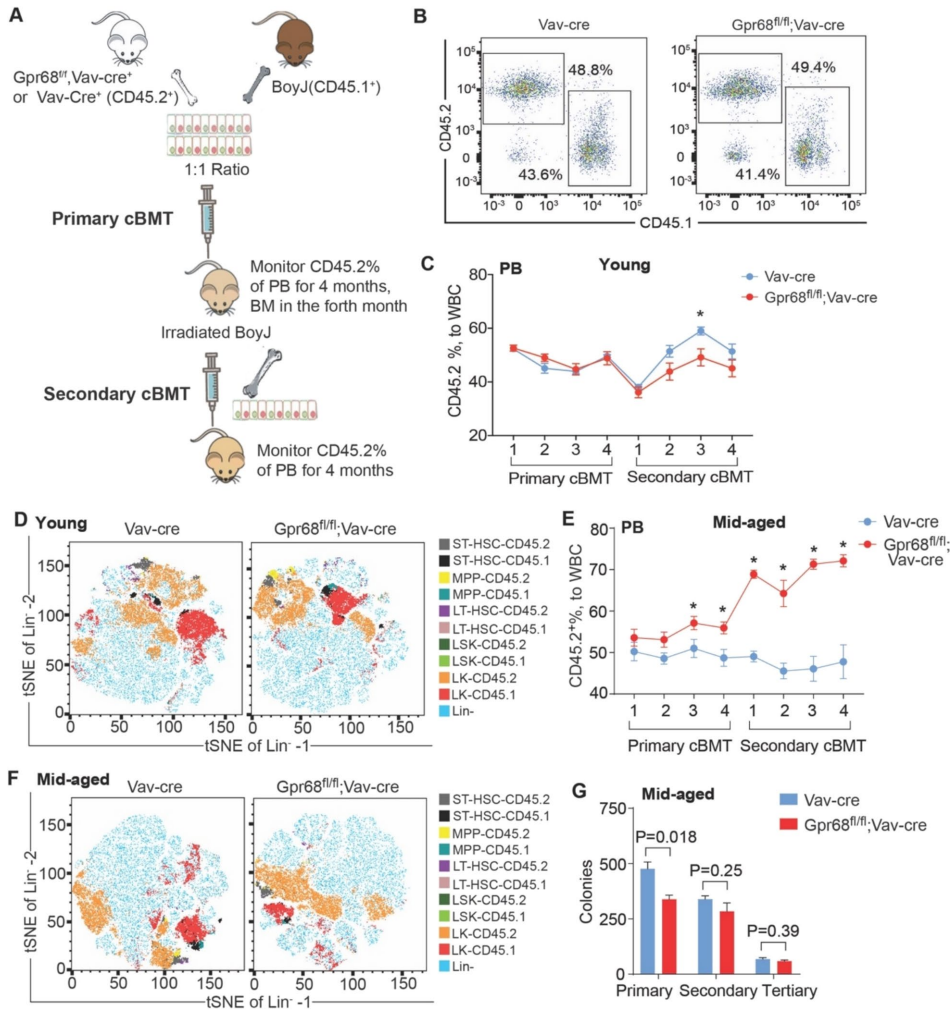
自然衰老关联:老年野生小鼠LT-HSC中GPR68表达显著降低,且凋亡减少,与基因敲除表型一致。
机制解析:
讨论
该研究首次揭示GPR68通过Ca2+/Caspase通路负调控LT-HSC功能。在衰老过程中,GPR68表达下降成为HSC适应代谢压力(如糖酵解减弱)的主动调节机制。这一发现为改善衰老相关贫血和免疫衰退提供了潜在干预策略——通过靶向GPR68-Ca2+轴可选择性增强HSC功能而不影响稳态造血。未来需进一步探索GPR68在人类HSC衰老中的作用及其与血液系统疾病的关联。
 生物通微信公众号
生物通微信公众号
知名企业招聘