
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:声动力仿生纳米药物抗击癌症
【字体: 大 中 小 】 时间:2025年07月31日 来源:Journal of Nanobiotechnology 12.6
编辑推荐:
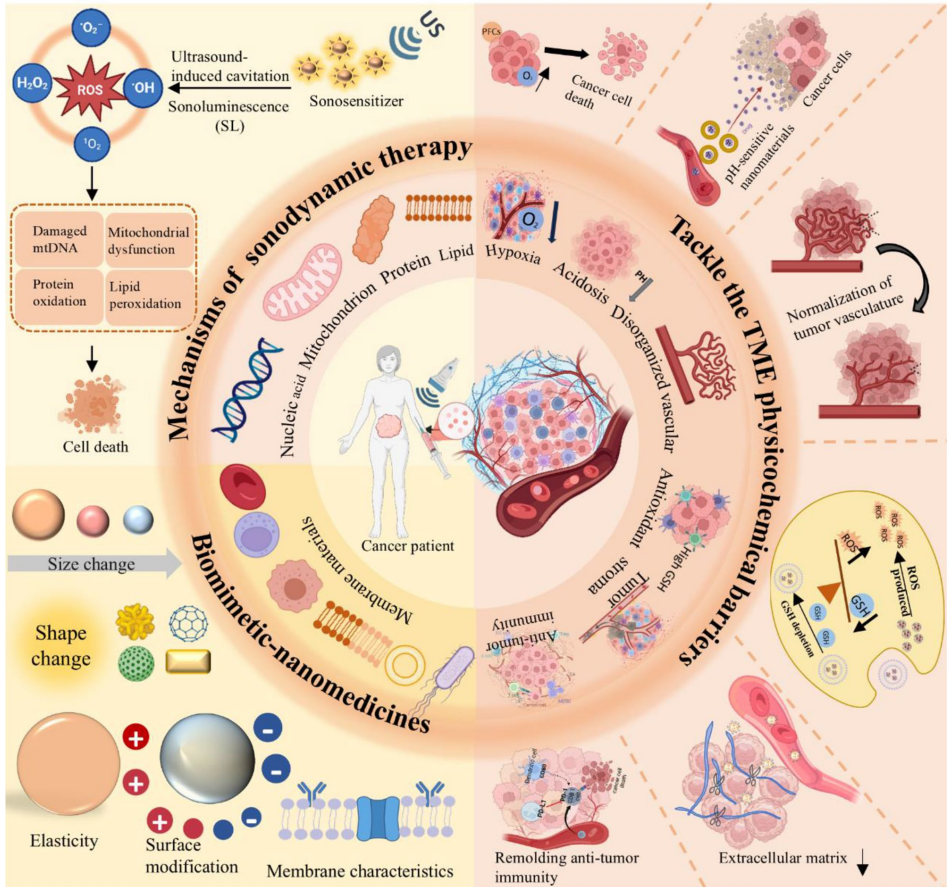
这篇综述系统阐述了声动力疗法(SDT)与仿生纳米药物(SBNM)的协同抗肿瘤策略,通过克服肿瘤微环境(TME)的理化屏障(如缺氧、酸性pH)和免疫抑制,显著提升治疗效果。文章详细解析了SDT的活性氧(ROS)杀伤机制、声敏剂分类(有机/无机/纳米技术增强型),并创新性提出六类仿生纳米载体(红细胞膜、免疫细胞膜、癌细胞膜、杂化膜、外泌体及微生物模拟),其核心优势在于精准靶向、免疫逃逸及可控药物释放。
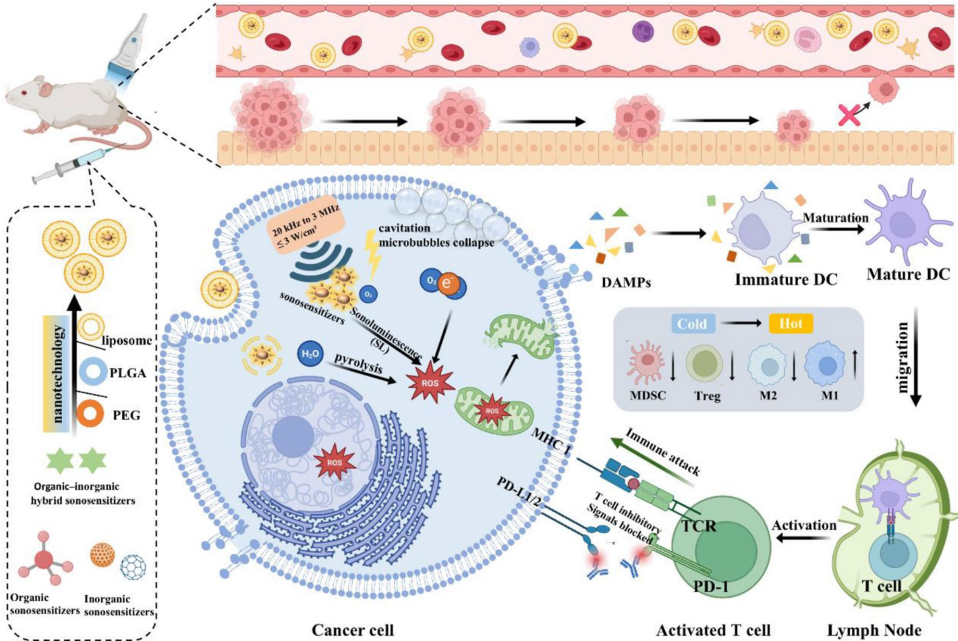
声动力疗法(SDT)利用低强度超声波激活声敏剂产生活性氧(ROS),通过氧化应激诱导肿瘤细胞死亡。其核心机制包括超声空化效应和声致发光(SL),前者通过微泡破裂产生高温(>10,000 K)和剪切力(>81 MPa),后者激发声敏剂电子-空穴对分离生成ROS。ROS(如O2•-、1O2)可破坏DNA、蛋白质和细胞骨架,而肿瘤细胞因固有高ROS水平更易受攻击。此外,SDT通过免疫原性细胞死亡(ICD)释放损伤相关分子模式(DAMPs),激活树突细胞(DCs)和T细胞,重塑抗肿瘤免疫。
声敏剂分为传统有机(如血卟啉、酞菁)和无机(如TiO2、ZnO)两类,但面临稳定性差、靶向性弱等问题。纳米技术通过封装(如PLGA、MOFs)和金属掺杂(如Au-TiO2)显著提升性能。例如,Cu掺杂碳点(Cu-CDs)同时引发"铜死亡";双金属氧化物MnWOx利用氧缺陷抑制电子-空穴复合,ROS产率超越传统声敏剂。
膜涂层纳米药物
外泌体与微生物模拟
SDT与免疫检查点抑制剂(如抗PD-1)联用可逆转免疫抑制。例如,gp100抗原修饰的HepG-6膜纳米粒通过DEC205促进DCs交叉呈递;CD47阻断剂RRx-001联合IR780声敏剂可促进M1型巨噬细胞极化。此外,工程化外泌体递送GSDMD-N mRNA可诱导焦亡,释放促炎因子增强免疫应答。
当前仿生纳米药物面临膜包覆不完全(<20%)、工艺标准化不足等问题。未来需优化超声参数个性化调控,并探索多机制协同治疗策略,如声动力-免疫-代谢联合疗法,以攻克肿瘤异质性难题。
 生物通微信公众号
生物通微信公众号
知名企业招聘