
-

生物通官微
陪你抓住生命科技
跳动的脉搏
膜蛋白CALM与磷脂酰肌醇4,5-二磷酸特异性结合的分子机制及其在网格蛋白介导的内吞作用中的三重膜曲率生成机制
【字体: 大 中 小 】 时间:2025年07月31日 来源:Communications Chemistry 6.2
编辑推荐:
本研究揭示了内吞适配蛋白CALM与含磷脂酰肌醇4,5-二磷酸(PtdIns(4,5)P2)模型膜结合的结构细节。通过多尺度生物物理技术组合,研究人员发现CALM通过其N端两亲性螺旋(AH0)插入膜头部区域,直接协调4-5个PtdIns(4,5)P2分子簇,同时降低局部膜刚度36%,增加粘弹性耗散,提出了由PtdIns(4,5)P2簇形成、螺旋插入诱导的脂质压缩和全局机械软化组成的三重膜曲率生成机制,为理解网格蛋白介导的内吞作用提供了新见解。
在真核细胞中,网格蛋白介导的内吞作用(Clathrin-mediated endocytosis, CME)是细胞选择性内化膜蛋白的主要机制。这一精密过程依赖于多种蛋白质与质膜内叶富含的磷脂酰肌醇4,5-二磷酸(PtdIns(4,5)P2)的相互作用。其中,网格蛋白组装淋巴髓系白血病蛋白(Clathrin assembly lymphoid myeloid leukaemia protein, CALM)作为最丰富的网格蛋白适配体之一,在CME过程中发挥着关键作用。然而,CALM如何特异性识别并结合PtdIns(4,5)P2,以及其如何参与膜曲率生成的分子机制仍不完全清楚。
来自欧洲多国研究机构(包括Institut Laue-Langevin、剑桥医学研究所等)的研究团队在《Communications Chemistry》发表了一项突破性研究。该研究采用多尺度生物物理技术组合,包括中子/X射线散射、固态核磁共振、原子力显微镜和石英晶体微天平等,系统研究了CALM与PtdIns(4,5)P2模型膜的相互作用,揭示了CALM作为膜曲率生成驱动者的三重作用机制。
研究人员采用了多项关键技术:中子反射技术(NR)用于测定CALM在膜上的取向和结合偏好;固态核磁共振(ssNMR)在原子水平解析膜-蛋白相互作用;原子力显微镜(AFM)的Peak Force QNM模式定量测量膜机械性能变化;石英晶体微天平(QCM-D)实时监测膜粘弹性变化;以及同步辐射X射线衍射(GIXD)分析脂质链的平面结构变化。这些技术的综合应用为理解CALM与膜的相互作用提供了多尺度视角。
CALM与质膜内叶模型膜的相互作用
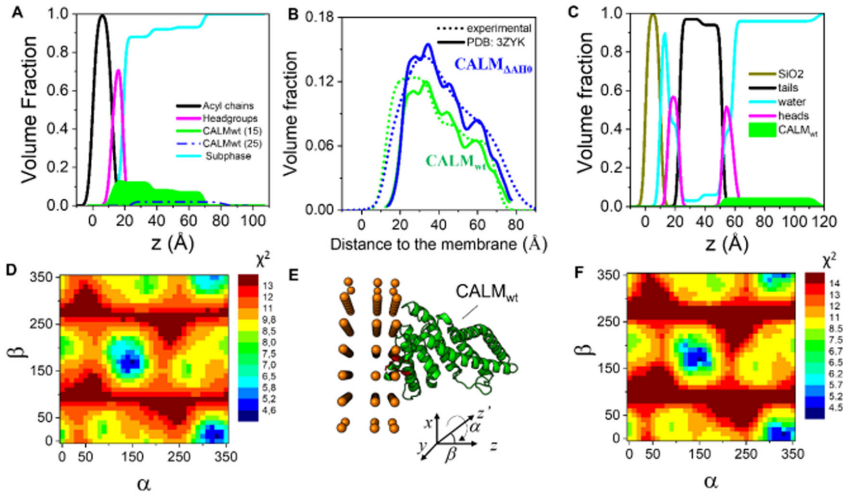
研究首先建立了模拟质膜内叶的磷脂单层模型系统,包含DPPC、DPPE和PtdIns(4,5)P2(7:2:1摩尔比)。表面压力-面积等温线测量显示,在低压缩性(高流动性)区域(15 mN/m),CALM结合显著增加表面压力(ΔΠ=9.5±0.5 mN/m),而在高密度排列区域(25 mN/m)结合减弱(ΔΠ=5±0.5 mN/m)。中子反射分析表明,CALM仅部分嵌入膜中(12%体积占有率),主要与头部基团区域相互作用(13%占有率)。

CALM的取向和PtdIns(4,5)P2结合偏好
通过原子模型辅助的中子反射数据分析,确定了CALM与膜结合的最佳取向(Euler角(α,β)=(330°,10°))。这一取向使CALM的PtdIns(4,5)P2结合位点(Lys28、38和40)朝向膜面,直接与PtdIns(4,5)P2磷酸基团相互作用。固态核磁共振进一步证实了这一相互作用,显示PtdIns(4,5)P2的P4和P5磷酸信号在CALM结合后向高场移动(分别从2.1和1.0 ppm移至2.7和1.6 ppm),表明负电荷减少的屏蔽环境。
两亲性螺旋AH0的膜插入
通过比较野生型CALM(CALMwt)和缺失AH0的突变体(CALM△AH0),研究发现AH0完全插入头部基团层,形成可能的楔形结构诱导膜曲率。NR分析显示,虽然CALM△AH0仍能结合膜,但其在头部基团层的插入体积减少(5±1% vs 13±1%),且界面粗糙度增加(8? vs 3?),表明AH0作为膜锚定物稳定蛋白质-膜相互作用。研究估算每个CALM分子与4-5个PtdIns(4,5)P2分子形成簇。
CALM对脂质双层粘弹性和局部刚度的影响
QCM-D测量显示,CALM结合导致频率下降(Δf)和耗散增加(ΔD),表明膜粘弹性增强。AFM的Peak Force QNM模式直接观察到CALM结合区域膜刚度从22 MPa降至14 MPa(降低36%),同时厚度增加。这种局部软化可能降低膜变形能垒,促进曲率生成。GIXD分析进一步发现,CALM结合导致脂质链排列更紧密,分子面积从63±2 ?2降至50±1 ?2,形成斜方晶格。

三重膜曲率生成机制
综合所有结果,研究提出了CALM驱动膜曲率的三重机制:(1)通过特异性磷酸相互作用实现PtdIns(4,5)P2介导的表面募集;(2)AH0螺旋插入产生不对称脂质堆积,在双层间产生差异应力;(3)粘弹性重塑局部软化膜同时全局增加能量耗散,从而降低曲率起始的热力学能垒。这一机制为理解网格蛋白包被小窝形成前的早期膜变形事件提供了分子基础。
这项研究的重要意义在于首次通过多尺度实验手段揭示了CALM与PtdIns(4,5)P2膜相互作用的定量结构细节,阐明了其作为膜曲率生成器的分子机制。发现不仅深化了对CME起始阶段的理解,也为相关神经退行性疾病(如阿尔茨海默病)中内吞功能障碍的研究提供了新视角。研究所建立的多技术整合方法也为其他膜-蛋白质相互作用研究提供了范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘