
-

生物通官微
陪你抓住生命科技
跳动的脉搏
BioLLM:单细胞基础模型集成与基准测试的标准化框架——推动单细胞转录组学分析的革命性突破
【字体: 大 中 小 】 时间:2025年07月31日 来源:Patterns 7.4
编辑推荐:
单细胞RNA测序(scRNA-seq)数据分析面临模型架构异质性和评估标准不统一的挑战。研究人员开发了BioLLM框架,通过标准化API实现scBERT、Geneformer、scGPT等单细胞基础模型(scFMs)的无缝集成,系统评估显示scGPT在零样本学习和微调任务中表现最优,为单细胞分析提供了可重复、高效的解决方案。该成果发表于《Patterns》杂志,将显著提升单细胞组学研究的质量和效率。
在单细胞组学技术蓬勃发展的今天,科学家们能够以前所未有的分辨率解析细胞异质性。单细胞RNA测序(scRNA-seq)技术已产生海量数据,但如何从这些复杂数据中提取生物学意义仍面临巨大挑战。传统分析方法往往需要针对特定任务从头训练模型,而新兴的单细胞基础模型(scFMs)虽然展现出强大潜力,却因架构差异、接口不统一等问题难以被研究者充分利用。这种"模型孤岛"现象严重阻碍了单细胞研究的进展。
中国科学院的邱平团队与BGI研究院合作开发了BioLLM框架,通过标准化接口整合了scBERT、Geneformer、scGPT和scFoundation等主流单细胞基础模型。研究发现scGPT在多数任务中表现最优,特别是在零样本细胞嵌入和细胞类型注释方面;Geneformer则在药物反应预测任务中展现出独特优势。这项发表于《Patterns》的研究为单细胞分析提供了首个系统性的模型集成解决方案,将显著提升研究的可重复性和效率。
研究采用了三项关键技术:1)基于决策树的标准化预处理流程,统一了不同模型的输入要求;2)模块化设计支持scFMs的即插即用,通过BioTask执行器实现零样本推理和微调任务的自动化;3)多维度评估体系,包括细胞嵌入质量(ASW评分)、基因调控网络(GRN)分析和分类任务指标等。
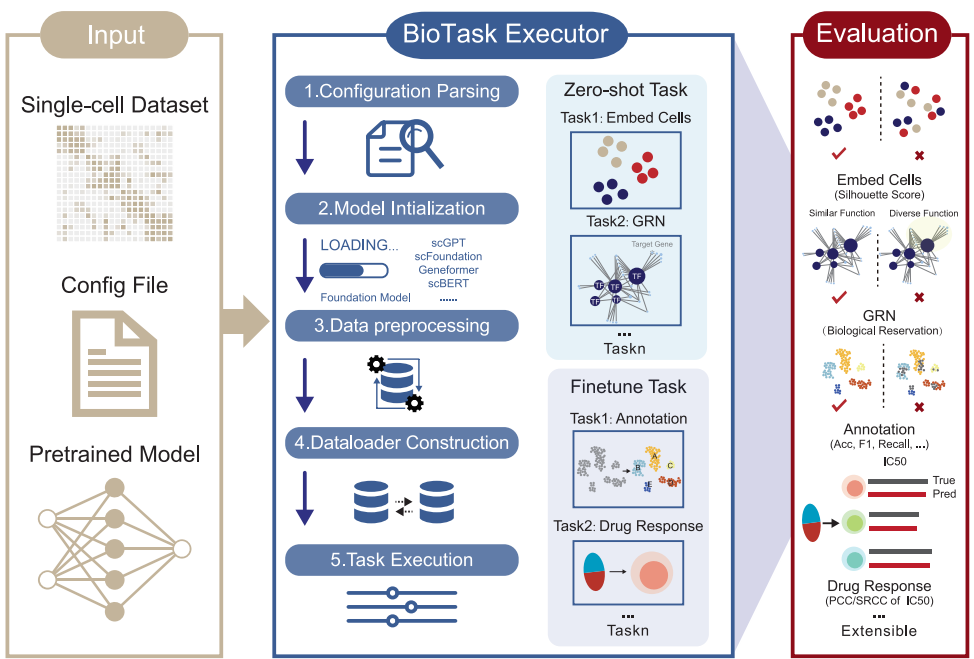
BioLLM框架由三个核心组件构成:输入模块负责接收数据和配置参数;BioTask执行器通过五步流程完成任务处理;评估模块则对结果进行多维度分析。这种设计使研究者能够轻松切换不同模型,同时保持分析流程的一致性。
在细胞表征能力评估中,scGPT生成的嵌入在ASW评分上显著优于其他模型,特别是在Zheng68K和肝脏等数据集上表现出优异的细胞类型区分能力。然而在批次效应校正方面,所有模型都面临挑战,其中scGPT虽优于主成分分析(PCA),但仍无法完全消除技术差异的影响。研究还发现输入基因序列长度对模型性能有显著影响,scGPT在长序列输入时表现更优,而scBERT则相反。

基因调控网络分析显示,scGPT和Geneformer能够识别更多富集的GO通路,特别是在低分辨率聚类时效果显著。以HLA-DRA基因为例的可视化分析证实,这些模型能准确捕捉免疫相关基因的调控关系,为理解基因互作机制提供了新工具。
在细胞注释任务中,scGPT在13个不同组织数据集上的表现超越传统工具如singleR和celltypist,特别是在稀有细胞类型识别方面优势明显。跨数据集评估进一步验证了其鲁棒性。值得注意的是,微调策略能显著提升模型性能,使scGPT在COVID-19和Lung-Kim数据集上的分类准确率提高约15%。

研究还将scFMs与生物信息学工具DeepCDR整合,用于癌症药物反应预测。结果显示,基于Geneformer和scGPT的特征提取使预测性能(PCC和SRCC)平均提升0.12,且在多种癌细胞系中保持稳定。这为个性化医疗中的药物筛选提供了新思路。
这项研究系统评估了当前主流scFMs的性能特点:scGPT凭借其生成式预训练策略在多数任务中领先;Geneformer在基因级任务和药物预测方面表现突出;而scBERT则因模型规模和训练数据限制处于劣势。研究还揭示了模型架构与性能的关系,如Transformer编码器的设计对细胞表征质量至关重要。
BioLLM框架的建立解决了单细胞分析领域的三个关键问题:模型选择的盲目性、分析流程的碎片化以及结果的可比性。虽然目前仅支持scRNA-seq数据,但其模块化设计为未来扩展留下了空间。随着CellPLM等新模型的加入,这一框架有望成为单细胞多组学分析的统一平台,推动精准医学和系统生物学研究进入新阶段。该成果不仅提供了实用的分析工具,更为单细胞人工智能的发展指明了方向——通过标准化和协作,释放基础模型的全部潜力。
 生物通微信公众号
生物通微信公众号
知名企业招聘