
-

生物通官微
陪你抓住生命科技
跳动的脉搏
揭秘癌细胞“不死之谜”:自动化技术助力探索癌细胞死亡机制
【字体: 大 中 小 】 时间:2025年07月04日 来源:安捷伦BioTek
编辑推荐:
在这篇应用指南中,我们使用Cytation联合BioSpa 的多板位活细胞分析组合,通过将长时间无标记细胞计数和荧光成像技术的联合应用,在384孔板中监测并量化多种抗肿瘤药物处理后HT-1080纤维肉瘤细胞系在72小时内的增殖和死亡情况。
癌细胞逃避细胞死亡是癌症发展的核心机制之一。正常情况下,细胞在完成其生命周期后,会通过凋亡这一程序性死亡方式,安静地退出历史舞台。然而,癌细胞却能够通过各种手段逃避凋亡,从而无限增殖,形成肿瘤。因此,深入研究癌细胞逃避死亡的机制,对于揭示癌症的本质、开发有效的癌症治疗方法具有重要意义。
方法推荐:多模式自动化高通量研究方法
基于细胞成像的研究平台为探索细胞死亡过程和研究细胞的不同死亡机制提供了一种连续、实时和高通量的方法。
在这篇应用指南中,我们使用Cytation联合BioSpa 的多板位活细胞分析组合,通过将长时间无标记细胞计数和荧光成像技术的联合应用,在384孔板中监测并量化多种抗肿瘤药物处理后HT-1080纤维肉瘤细胞系在72小时内的增殖和死亡情况。

Cytation + BioSpa 多板位自动化活细胞工作站
样本制备
HT-1080 细胞在含有 10% FBS、2 mM 谷氨酰胺和青霉素/链霉素抗生素的 Advanced DMEM 培养基中, 37 °C 、5% CO2 培养。当细胞达到80% 密度时,定期传代。收集 HT-1080 细胞并悬浮后,以每个孔 500 个细胞的密度接种于 384 孔板中。细胞贴壁后(约 4 小时),将培养基更换为 Fluorobrite DMEM 培养基。将 Kinetic Apoptosis Kit 试剂添加到每个孔中,使最终浓度为 1μL/mL pSIVA-IANBD 和 2 μL/mL PI。在微孔板上加入4种抗肿瘤药物稀释液,并在加药后立即开始成像分析。
自动化长时间活细胞成像程序设置
为实现全自动长时间成像,将细胞培养在与 Cytation 联用的 BioSpa 8 中,在整个72 小时的实验期间,BioSpa 8 在 37 °C、5% CO2 和湿度 80%–90% 的环境下培养细胞,并通过 BioSpa 软件对环境参数进行监测和实时报告。每隔 2 小时,384孔板自动从 BioSpa 培养箱转移到 Cytation 5进行细胞成像,在整个成像过程中,Cytation 5 内置的环境控制功能使成像环境与BioSpa 保持一致,为细胞提供稳定的培养条件。Cytation 5 所使用的宽视野相机仅需一张图片即可采集整个样本孔的图像,最大程度地减少图像采集时间。
72小时无人值守的细胞增殖与凋亡实验开始了,明场成像和荧光成像轮番进行,由智能化Gen 5 软件执行图像采集和所有的数据分析,包括曲线拟合与统计学分析。
数据表现与解读
本文研究了四种抗肿瘤药物(十字孢碱、诺考达唑、喜树碱和尼日利亚菌素)对细胞增殖的影响。实验结果显示,四种抗肿瘤药物对癌细胞的增殖和死亡产生了显著影响。通过Gen5软件生成的细胞计数曲线,研究者们可以直观地看到整个384孔板中癌细胞的增殖速率。

图1. 384 孔板细胞增殖曲线。红色曲线展示了在为期三天的实验过程中细胞数量的变化趋势。随着药物浓度从 C 行逐渐增加至 P 行,所有药物均导致孔板中细胞增殖水平下降。
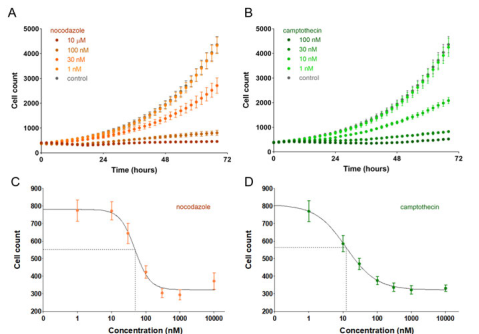
图2. HT-1080 纤维肉瘤细胞增殖的剂量依赖性抑制。将几种浓度的 (A) 诺考达唑(橙色圆,n = 12 个重复测定孔)和 (B) 喜树碱(绿色圆,n = 12 个重复测定孔)在三天内的平均细胞计数图叠加。Agilent BioTek Gen5软件生成 (C) 诺考达唑(橙色圆)和 (D) 喜树碱(绿色圆)在 24 小时的单一时间点无标记细胞计数的剂量-响应曲线。4 参数拟合用黑色实线表示, IC50 值用虚线表示。诺考达唑的 IC50 对应于 48 nM,喜树碱对应于 12 nM。
此外,我们还利用荧光报告基因对凋亡和坏死机制进行了深入研究。在拍摄明场图像的同时,拍摄细胞凋亡标志物 pSIVA 和坏死标志物 PI 的相应荧光图像(图 3A)。识别 pSIVA 和 PI 信号阳性的细胞(图 3B),并用一级 Mask 识别每个孔和时间点的单个细胞。
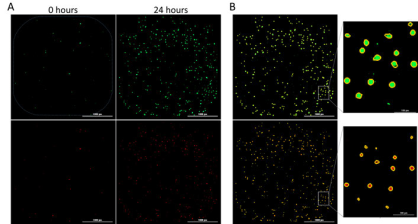
图3. 细胞凋亡和坏死阳性细胞的捕获和识别。(A) 两个时间点 pSIVA 凋亡标志物(绿色,上图)和 PI坏死标志物(红色,下图)阳性细胞的示例图像。 (B) 通过细胞大小和信号阈值参数识别阳性凋亡和坏死细胞,并通过一级 Mask 识别阳性细胞。
值得注意的是,在实验中,我们发现了一种有趣的现象:在某些药物浓度下,尽管许多细胞正在经历凋亡或坏死,但总细胞数仍然在增加。这可能是由于癌细胞的快速增殖能力导致的。为了准确评估药物对癌细胞死亡的影响,我们将荧光信号(代表凋亡或坏死的细胞数)与无标记细胞计数进行了归一化处理。这种归一化方法消除了由于增殖速率差异引起的偏差,使得EC50值的确定更加准确。
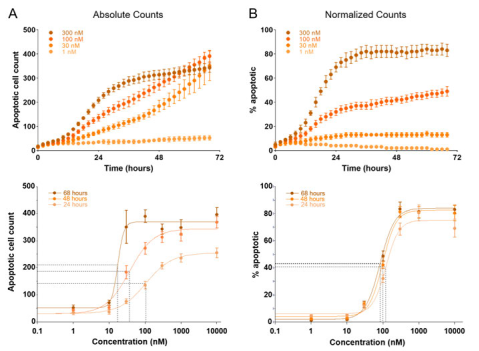
图4. 抗肿瘤药物诱导的细胞凋亡信号响应。(A) 诺考达唑在四种浓度下的细胞凋亡计数。由于总细胞计数增加,中间浓度下凋亡细胞计数继续上升。通过绝对细胞计数生成剂量-响应曲线,并拟合至指定的三个时间点。由于细胞增殖,EC50 值随时间显著左移(EC50 24 小时 = 106 nM,EC50 48 小时 = 30 nM,EC50 68 小时 = 17 nM)。(B) 与图 A 中凋亡细胞计数的数据相同,但以总细胞数进行归一化(以百分比表示)。数据归一化后,所有剂量-响应曲线的 EC50 值均为约 100 nM。在A 和 B 下图中,Agilent BioTek Gen5软件的 4 参数拟合线以实线显示,EC50 插值线以虚线显示。
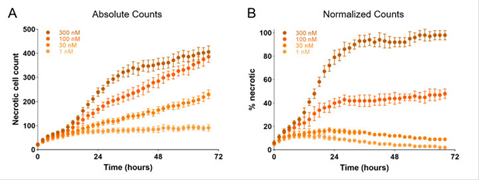
图5. 抗肿瘤药物诱导的细胞坏死信号响应。(A) 诺考达唑在四种浓度下的细胞坏死计数,(B) 数据归一化之后的计数结果。
为了比较和定量药效,对所有药物在 24 小时的归一化坏死和凋亡信号进行了动力学分析和曲线拟合(图 24)。有趣的是,尽管尼日利亚菌素具有抑制增殖的功效(IC50 = 100nM,图 20C),但即使在使用的最高浓度下,它也很少导致细胞凋亡或坏死,并且细胞凋亡和坏死的 EC50 值尚未确定。
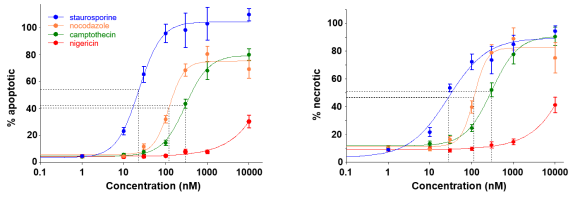
图6. 细胞凋亡和坏死的 EC50 测定。绘制每种药物的坏死细胞百分比(左图)和凋亡细胞百分比的剂量-响应曲线。Agilent BioTek Gen5软件进行 4 参数拟合(实心彩色线)以及插值 EC50 值(虚线)。
此外,尽管两个过程的 EC50 值相似,但与坏死百分比相比,十字孢碱的最大平台值的凋亡百分比达到了更高水平。这种差异可能表明,十字孢碱优先启动HT-1080 细胞凋亡。因此,我们还使用 Gen5 对细胞凋亡和坏死信号的开始时间进行了定量研究。结果表明只有十字孢碱的两种信号开始时间存在差异,凋亡比坏死早约 3.5 小时。
该研究方法的优势与普适性
本应用指南中推荐的研究方法具有显著的优势和普适性。首先,该技术结合了自动化和高通量的特点,能够在短时间内处理大量的样本和数据,大大提高了实验效率。其次,通过无标记细胞计数和荧光成像的结合,研究者们能够同时监测癌细胞的增殖和死亡情况,从而获得更加全面的信息。此外,该技术的普适性也很强,可以应用于不同类型的癌细胞系和抗肿瘤药物的筛选中。
全面而灵活:Agilent BioTek Cytation 系列细胞成像多功能微孔板检测系统 >>
设备推荐:
 Agilent BioTek Cytation 5 细胞成像多功能微孔板检测系统
Agilent BioTek Cytation 5 细胞成像多功能微孔板检测系统

Agilent BioTek Cytation 5 细胞成像多功能微孔板检测系统将自动化数字显微成像和微孔板检测结合到了一个模块化、可升级的平台中。显微成像模块可在荧光、明场、高对比度明场、彩色明场和相差通道成像下提供高达 60 倍的放大倍率;温控至 65 °C 和 CO2/O2 控制可为细胞成像工作流程提供稳定条件。
 Agilent BioTek BioSpa 全自动培养箱
Agilent BioTek BioSpa 全自动培养箱

Agilent BioTek BioSpa全自动培养箱与 Agilent BioTek Cytation 细胞成像微孔板检测系统整合,支持在多达 8 块微孔板或其他样品容器中实现动力学活细胞分析工作流程的自动化。温度和 CO2/O2 控制以及湿度监测可为长时程活细胞成像工作流程提供有力支持。并可集成液体处理,实现进一步的流程自动化。