
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于脂代谢基因特征的ER阳性乳腺癌他莫昔芬治疗预后模型构建与肿瘤微环境异质性解析
【字体: 大 中 小 】 时间:2025年08月01日 来源:BMC Medical Genomics 2
编辑推荐:
本研究针对ER阳性乳腺癌患者他莫昔芬治疗后部分患者出现复发或死亡的问题,通过整合脂代谢基因表达与机器学习数据,开发了包含PDGFB、PPT1等6个基因的预后模型。该模型在TCGA和4个GEO数据集中验证显示5年生存预测AUC达0.858,能有效区分高低风险组(p<0.01),并揭示USH2A/KMT2C突变、JAK-STAT通路激活及M0巨噬细胞浸润等特征。单细胞测序发现该特征与髓系细胞增殖和SPP1信号通路相关,为ER+乳腺癌精准治疗提供新策略。
在乳腺癌治疗领域,雌激素受体阳性(ER+)亚型占所有病例的70%以上,他莫昔芬作为内分泌治疗的基石药物已使用数十年。然而临床观察发现,约30%患者最终会出现耐药和复发,这一现象如同悬在患者头上的"达摩克利斯之剑"。传统临床指标如ER/PR/HER2状态虽能预测部分疗效,但面对复杂的肿瘤异质性和动态演变的耐药机制仍显不足。更棘手的是,近年研究发现脂代谢重编程与内分泌治疗敏感性密切相关——脂肪酸合成酶(FASN)促进耐药,而c-Jun靶向却能增强敏感性,这些线索暗示脂代谢网络可能是破解耐药迷局的关键。
为解决这一临床难题,复旦大学上海癌症中心乳腺外科的研究团队开展了一项创新性研究。他们从1026个脂代谢相关基因出发,通过机器学习构建了包含PDGFB、PPT1、HADHA等6个关键基因的预后模型,相关成果发表在《BMC Medical Genomics》。这项研究最引人注目的发现是:该模型不仅能准确预测患者5年生存率(AUC=0.858),更首次通过单细胞测序揭示脂代谢特征与肿瘤微环境中髓系细胞动态的深层联系,为理解他莫昔芬耐药提供了全新的微环境视角。
研究主要采用四种关键技术方法:1)基于TCGA和4个GEO数据集(GSE17705等)的转录组机器学习建模;2)TIMER2.0和CIBERSORT算法评估免疫浸润;3)GSE176078单细胞数据集解析细胞亚群;4)CellChat软件重构细胞间通讯网络。所有分析均使用ER+且接受他莫昔芬治疗的乳腺癌样本(总计832例)。
【Signature construction in TGCA-ER+Tamoxifen-BRCA dataset】
研究团队从TCGA数据库中筛选183例接受他莫昔芬治疗的ER+乳腺癌患者,通过穷举法从23个候选基因中确定最优6基因组合:PDGFB(促血管因子)、PPT1(棕榈酰蛋白硫酯酶)、HADHA(线粒体三功能酶)、AKR1C3(醛酮还原酶)、KIT(干细胞因子受体)和CYP26A1(维甲酸代谢酶)。风险评分公式显示,PDGFB和CYP26A1高表达预示不良预后,而PPT1和KIT则具有保护作用。模型将患者分为高低风险组后,5年生存率差异显著(p<0.001),且所有死亡病例均集中在高风险组。
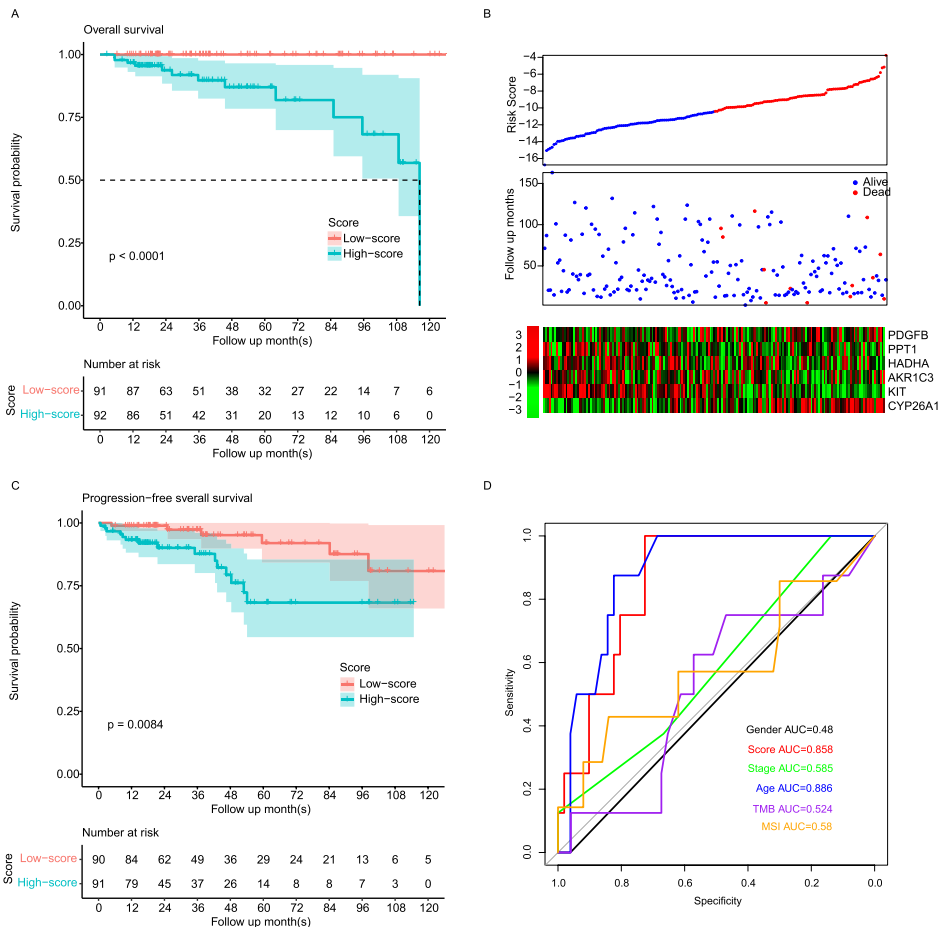
【Signature validation】
在4个独立验证集中(总计649例),模型展现出跨平台稳定性。GSE17705(n=298)数据显示高风险组死亡风险增加3.2倍(HR=3.2, 95%CI:1.8-5.7),且各组均保持相似的基因表达模式。值得注意的是,微阵列数据与RNA-seq数据的兼容性验证了模型的临床适用性。
【Clinical associations】
与常规认知不同,该模型与病理分期无关(p=0.34),但与年龄显著相关(p=0.008)。多因素Cox分析证实其独立性(HR=2.99, p=0.002)。引人注目的是,模型与PD-L1表达呈负相关(R=-0.19, p=0.00093),暗示脂代谢可能通过免疫检查点调控耐药。
【Genetic correlations】
基因组分析揭示高风险组特有突变谱:USH2A(听觉相关蛋白)突变率9.1×10-15,KMT2C(组蛋白甲基转移酶)突变率5.4×10-9。拷贝数变异分析显示高风险组基因组扩增事件增加2.3倍,提示基因组不稳定性可能是脂代谢异常的驱动因素。
【Pathway associations】
GSEA分析揭示高风险组JAK-STAT通路(padj<0.01)和细胞因子-受体相互作用通路激活,而低风险组糖醛酸代谢活跃。这些发现将脂代谢重编程与已知耐药机制联系起来,为联合靶向治疗提供理论依据。
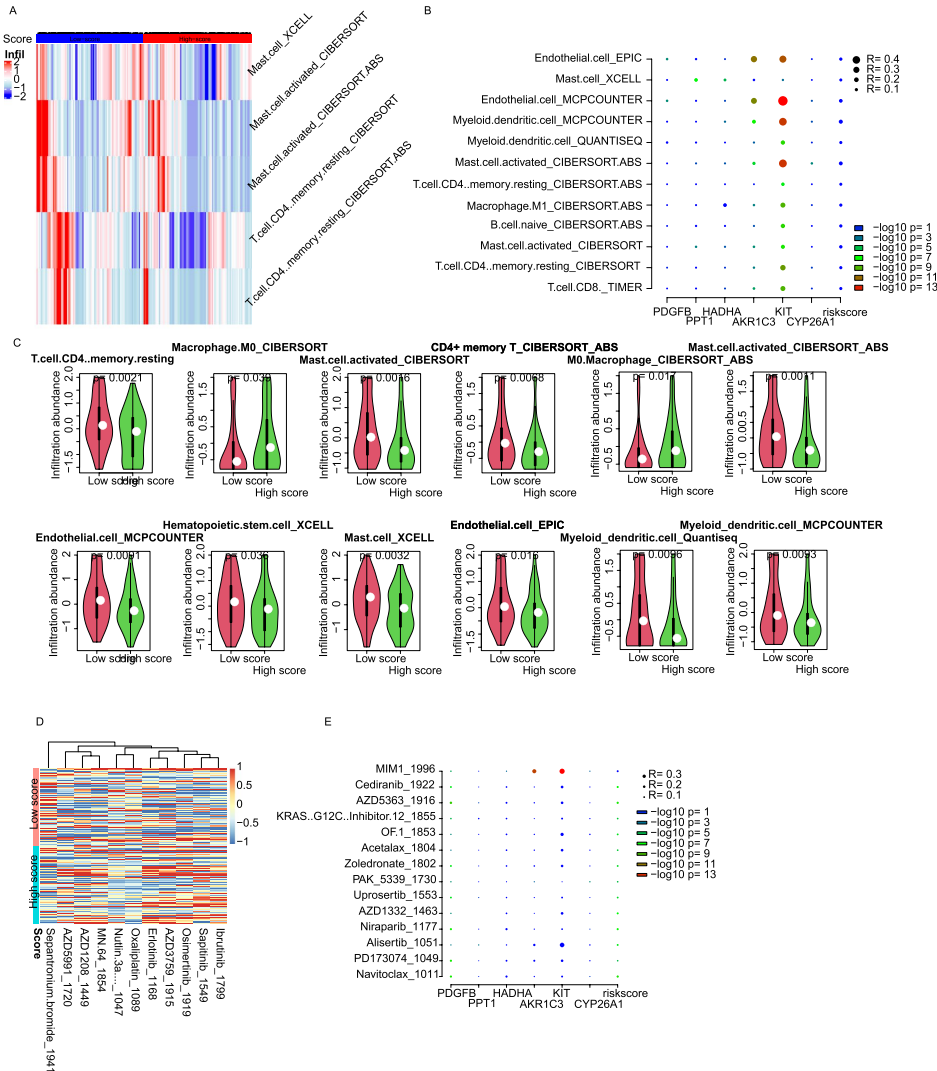
【Immune infiltration and drug sensitivity】
免疫浸润分析显示低风险组富含静息CD4+记忆T细胞(p=0.003)和活化树突细胞(p=0.007),而高风险组M0型巨噬细胞增加2.1倍(p=0.001)。药物敏感性预测显示低风险组对常规化疗更敏感(IC50降低37%),而高风险组对Sepantronium bromide(凋亡诱导剂)敏感性增加。
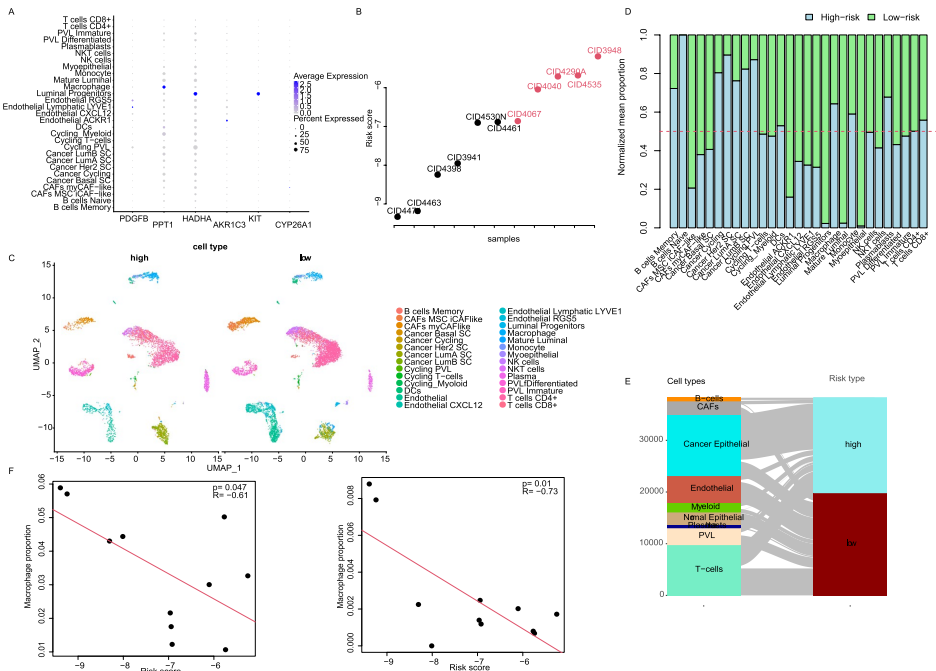
【Tumor microenvironment and the model】
单细胞测序揭示PPT1在巨噬细胞高表达,KIT在管腔祖细胞特异表达。高风险组增殖性髓系细胞比例增加(R=-0.73, p<0.001),且细胞互作强度降低37%。特别值得注意的是,高风险组SPP1(骨桥蛋白)信号通路激活,而低风险组保留SIRPα/CD47免疫检查点通路。
这项研究通过多组学整合分析,建立了首个基于脂代谢基因的ER+乳腺癌他莫昔芬治疗预后模型。其重要意义体现在三方面:首先,6基因签名较传统临床指标具有更好的预测性能(AUC提高12%);其次,发现USH2A/KMT2C突变与脂代谢异常的关联,为耐药机制研究开辟新方向;最后,单细胞层面揭示SPP1信号通路与髓系细胞增殖的关联,提示靶向肿瘤微环境的联合治疗策略。值得注意的是,模型与PD-L1表达的负相关暗示免疫治疗可能对高风险患者特别有效,这一假设值得后续临床试验验证。
研究的局限性在于回顾性设计可能引入选择偏倚,且缺乏体外实验验证机制。未来研究可关注:1)开发标准化检测试剂盒推动临床转化;2)探索PPT1抑制剂与他莫昔芬联用的协同效应;3)在类器官模型中验证SPP1通路的作用。总的来说,这项工作不仅提供了实用的预后工具,更深化了对乳腺癌代谢-免疫串扰的理解,为精准医疗时代下的个体化治疗决策提供了新思路。
 生物通微信公众号
生物通微信公众号
知名企业招聘