
-

生物通官微
陪你抓住生命科技
跳动的脉搏
常染色体显性遗传性视神经萎缩(DOA)患者视觉功能长期保持良好状态的病例研究及基因诊断价值
【字体: 大 中 小 】 时间:2025年08月02日 来源:BMC Ophthalmology 1.7
编辑推荐:
本研究报道了一例56岁男性患者,其携带OPA1基因新型杂合剪接位点突变(c.2331+2T>G),却长期保持相对良好的视觉功能(BCVA 0.6-1.0)。通过光学相干断层扫描(OCT)发现特征性视盘周围神经纤维层变薄,结合蓝黄视野检查发现亚临床功能障碍,最终经全外显子测序确诊为常染色体显性视神经萎缩(ADOA)。该研究揭示了ADOA临床表现的高度异质性,强调了基因检测在不明原因视神经萎缩诊断中的关键作用。
在眼科遗传性疾病领域,常染色体显性遗传性视神经萎缩(ADOA)一直是个充满谜团的疾病。这种由OPA1基因突变导致的神经退行性疾病,通常会在青少年时期就表现出明显的视力下降,多数患者最终视力稳定在0.1左右。然而,临床医生们偶尔会遇到一些"不按常理出牌"的病例——他们可能直到中年才出现轻微症状,甚至保持相对良好的视力,这给诊断带来了巨大挑战。
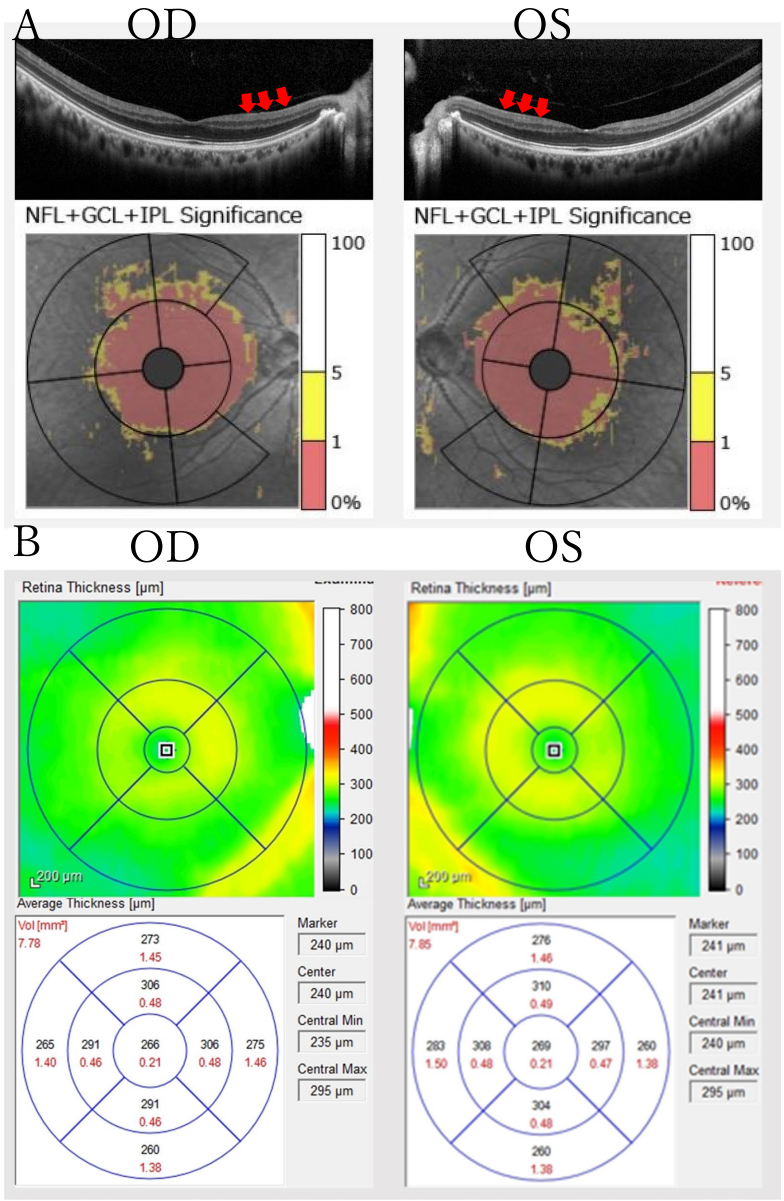
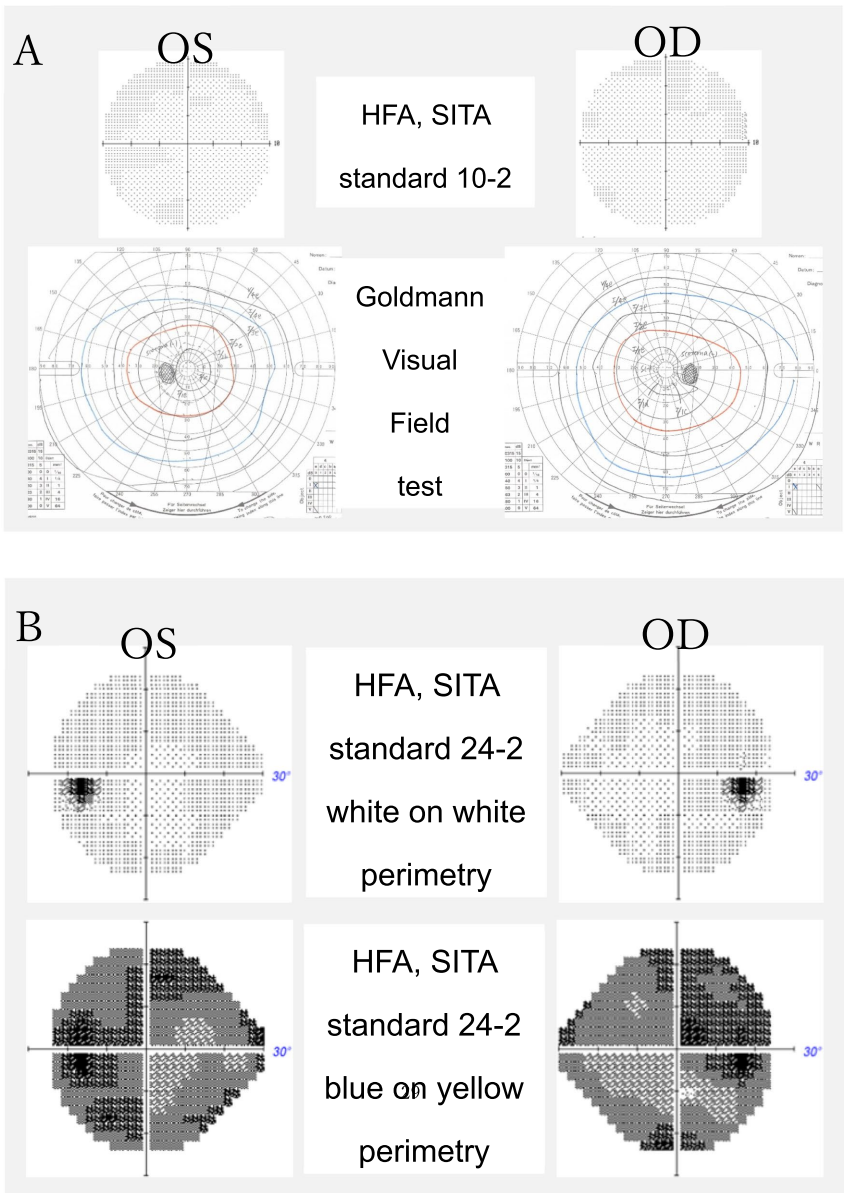
埼玉医科大学医学院眼科的研究团队在《BMC Ophthalmology》发表了一项引人入胜的病例研究。他们追踪观察了一位56岁男性患者长达7年,这位患者最初因视力模糊就诊时,双眼最佳矫正视力(BCVA)仍保持在1.0(相当于Snellen视力表的20/20),仅通过光学相干断层扫描(OCT)发现视盘颞侧神经纤维层变薄这一细微线索。随着时间的推移,患者视力缓慢下降至0.6-0.8,但常规视野检查(Goldmann和Humphrey 30-2)仍未发现异常。研究人员运用多种先进技术手段,包括蓝黄视野检查、视网膜电图(ERG)、临界融合频率(CFF)测定等,最终通过全外显子测序发现了一个前所未见的OPA1基因剪接位点突变(c.2331+2T>G),确诊为ADOA。
研究采用的关键技术包括:1)标准化的视力功能评估(BCVA、CFF、对比敏感度和色觉检查);2)多模式视野分析(HFA SITA标准10-2/24-2白-白视野和蓝-黄视野);3)高分辨率OCT视网膜分层成像;4)全视野和局部黄斑视网膜电图(ERG)记录;5)基于全外显子测序的基因检测及生物信息学分析(SpliceAI预测)。
【背景】研究首先回顾了ADOA的典型特征:多在20岁前发病,视力进行性下降至0.1左右,常伴色觉障碍和中心暗点。但强调约20-30%患者表现为非典型症状,部分无症状突变携带者仅通过OCT可发现异常。本研究病例的特殊性在于:中年发病、视力保持良好、缺乏家族史,这些特点使诊断尤为困难。
【病例展示】详细记录了患者7年随访数据:49岁时BCVA 1.0,仅OCT显示颞侧RNFL变薄;54岁时视力降至0.6-0.8,蓝黄视野检查发现弥漫性敏感度下降,而常规视野检查仍正常;55岁时视力保持稳定。特别值得注意的是,虽然患者存在轻度白内障,但视力下降程度与晶体混浊程度不符,且色觉(Panel D-15)和视网膜电图(包括振荡电位OPs和光负反应PhNR)均正常,这些证据排除了其他常见病因。
【影像学发现】
【功能检查】
【基因诊断】通过全外显子测序发现OPA1基因新型杂合变异c.2331+2T>G,位于内含子23的经典剪接位点。SpliceAI预测评分1.00(满分),表明该变异导致剪接供体位点破坏。根据ACMG指南,该变异被判定为致病性(PVS1+PM2+PP3)。
【讨论与结论】研究强调了几个重要观点:1)ADOA可表现为"温和型",患者到中年仍保持较好视力;2)OCT发现的RNFL变薄是重要警示信号,即使视力良好也应考虑遗传检测;3)蓝黄视野比标准视野更敏感,能早期发现功能异常;4)新发现的c.2331+2T>G变异拓展了OPA1基因突变谱。这项研究为眼科医生提供了重要启示:对于不明原因的视神经萎缩,即使缺乏典型症状和家族史,也应考虑ADOA可能,及时进行OCT检查和基因检测,避免漏诊和误诊。
 生物通微信公众号
生物通微信公众号
知名企业招聘