
-

生物通官微
陪你抓住生命科技
跳动的脉搏
STELLA:基于元启发式算法的药物设计框架实现片段级化学空间探索与多参数平衡优化
【字体: 大 中 小 】 时间:2025年08月03日 来源:Scientific Reports 3.9
编辑推荐:
研究人员开发了STELLA框架,通过结合进化算法和聚类构象空间退火方法,解决了传统药物发现中化学空间探索不足和多参数优化困难的问题。该框架能生成更多独特骨架的候选分子(217%提升),在16个参数同步优化中显著优于REINVENT 4和MolFinder,为从头药物设计提供了高效工具。
在药物发现领域,如何从理论上1030-1060种可能的有机化合物中高效筛选出理想药物分子,一直是困扰研究人员的"大海捞针"难题。传统虚拟筛选方法受限于计算成本,而深度学习模型又依赖大量训练数据。更棘手的是,药物开发需要同时优化相互冲突的16种性质参数,如结合亲和力(docking score)、类药性(QED)和ADMET特性,这使得现有工具往往陷入局部最优解。
Standigm公司的研究团队在《Scientific Reports》发表的STELLA框架,创新性地将进化算法与聚类构象空间退火(CSA)相结合。该系统通过FRAGRANCE片段替换技术,在保持核心骨架不变的前提下,对非骨架片段进行智能替换,每次迭代生成3000个变异分子。独特的MCS(最大共同子结构)交叉算法将分子转化为片段级图谱,通过"最近MCS原子索引"和"核心距离"双重属性指导重组。实验显示,针对PDK1抑制剂设计,STELLA的命中率(5.75%)是REINVENT 4的3倍,产生的独特Murcko骨架数量(276个)多出161%。在Abl1/p53双靶点16参数优化中,其目标函数值分别降低1.03和0.46,化学空间探索范围扩大251%(Abl1)和210%(p53)。
关键技术包括:1)FRAGRANCE片段库(260万片段)的115维特征向量匹配;2)基于Gold.PLP.Fitness和QED的加权目标函数;3)渐进式距离截断(dcutoff)聚类选择策略;4)图变换器(graph transformer)ADMET预测模型QIP-ADMET。
结果分析
比较REINVENT 4案例研究
STELLA在GOLD PLP Fitness(76.80±4.81)和QED(0.77±0.06)双指标上均显著优于REINVENT 4。如图2所示,其帕累托前沿(Pareto frontier)分布更优:
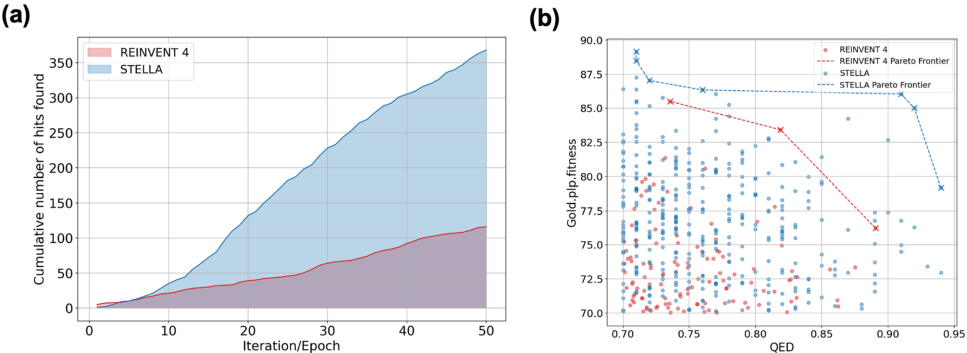
多参数优化基准测试
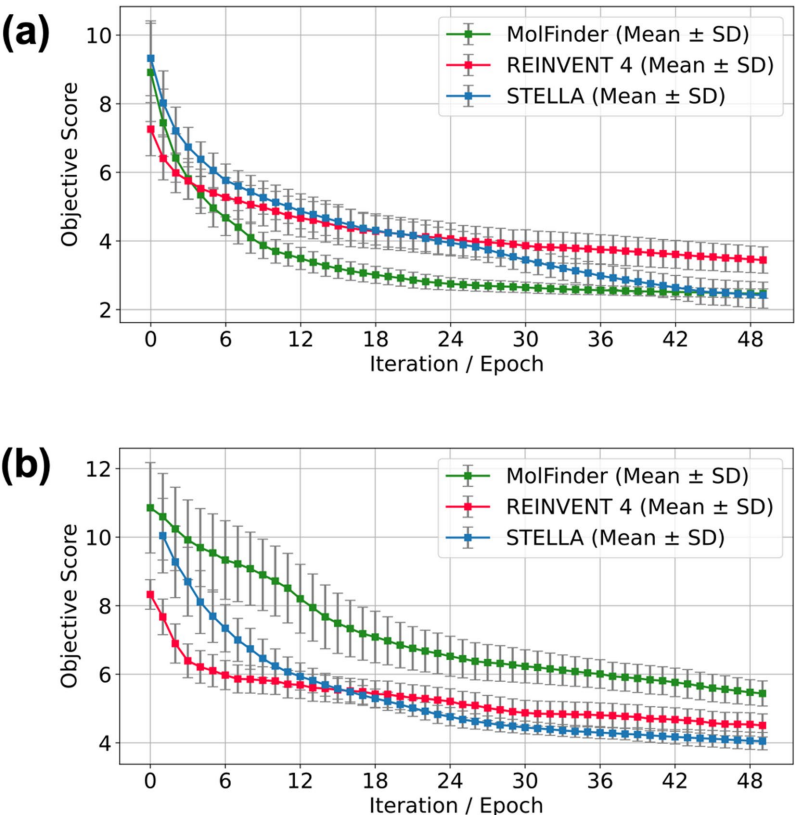
在Abl1优化中,STELLA平均目标分数(2.42±0.38)优于MolFinder(2.47±0.14),其分子对相似度(0.28)更低,表明更好的多样性保持。如图3所示,经过23次迭代后超越REINVENT 4的优化效率:
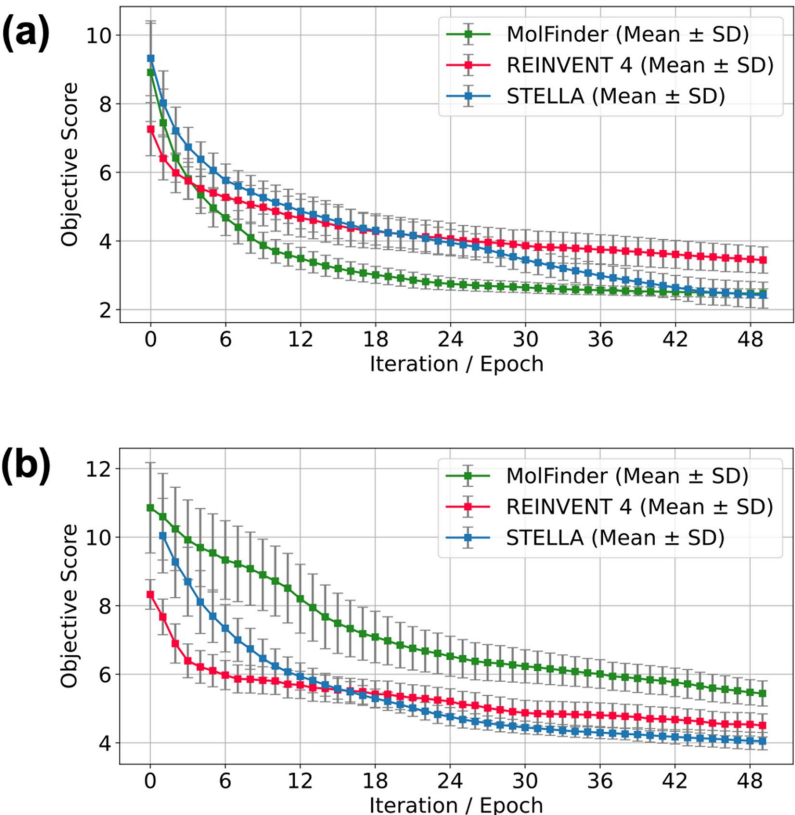
化学空间探索能力
通过Sphere Exclusion聚类分析,STELLA在Abl1案例中产生251个簇,是REINVENT 4(42簇)的6倍。如图4所示,其分子在化学空间中的分布更广:
该研究通过元启发式算法与深度学习的融合,解决了药物设计中"探索-开发"两难问题。STELLA的渐进式dcutoff调整策略(从0.5降至0.2)实现了从全局探索到局部优化的自然过渡,其片段级操作相比原子级修改(如EvoMol的Cut atom)更符合合成可行性。未来整合更多生成模型和ADMET预测模块,或将进一步推动AI药物设计的发展。
 生物通微信公众号
生物通微信公众号
知名企业招聘