
-

生物通官微
陪你抓住生命科技
跳动的脉搏
小檗碱通过保护肠道屏障和抑制炎症小体激活预防NSAID所致小肠损伤的机制研究
【字体: 大 中 小 】 时间:2025年08月04日 来源:Digestive Diseases and Sciences 2.5
编辑推荐:
本研究针对非甾体抗炎药(NSAID)诱发小肠损伤的临床难题,通过小鼠模型和人肠道类器官实验,揭示传统中药小檗碱(BBR)通过维持紧密连接蛋白(Claudin-1/Occludin)表达、抑制NLRP6/NLRC4炎症小体激活,显著降低IL-1β/TNF-α等促炎因子水平,为NSAID肠病防治提供了新策略。
非甾体抗炎药(NSAID)作为全球使用最广泛的解热镇痛药,在带来疗效的同时也造成严重的小肠黏膜损伤。随着胶囊内镜技术的普及,临床发现超过70%长期服用NSAID的患者存在小肠溃疡、穿孔等并发症。令人担忧的是,传统胃保护药物质子泵抑制剂(PPI)不仅无效,反而可能加重损伤。面对这一临床困境,来自Okayama University Graduate School of Medicine(冈山大学医学系研究科)的Mikako Ishiguro团队在《Digestive Diseases and Sciences》发表重要研究,揭示传统中药小檗碱(Berberine, BBR)通过双重机制——保护肠道物理屏障和抑制炎症小体激活,有效预防NSAID所致小肠损伤。
研究采用BALB/c小鼠吲哚美辛(IND)诱导模型和人iPSC来源肠道类器官,通过FITC-葡聚糖渗透实验、多重细胞因子检测、Western blot和免疫荧光等技术,系统评估BBR的肠保护作用。关键发现包括:在NSAID处理小鼠中,BBR使小肠溃疡减少83%,血清IL-1β和TNF-α水平分别降低62%和58%;机制上证实BBR能维持紧密连接蛋白Claudin-1和Occludin的表达完整性,同时抑制NLRP6/NLRC4炎症小体通路,减少Caspase-1活化。特别值得注意的是,人肠道类器官实验首次证实BBR可直接作用于上皮细胞,独立于免疫调节发挥保护效应。

BBR预防NSAID诱导小肠损伤的研究结果主要体现在以下方面:
BBR显著减轻NSAID诱导的肠道病理损伤
动物实验显示,BBR处理组小鼠小肠长度比损伤组增加22%,溃疡数量减少5.8倍。Evans蓝染色证实BBR组损伤面积缩小84%,组织学显示回肠绒毛高度保持完整。FITC-葡聚糖渗透实验表明,BBR使肠道通透性降低至接近正常水平,血浆荧光强度仅为损伤组的37%。
BBR直接保护肠道上皮屏障功能
人肠道类器官模型揭示,BBR处理使NSAID导致的 Claudin-1和Occludin表达下调分别逆转71%和65%,免疫荧光显示BBR能维持这两种蛋白的连续带状分布。有趣的是,支架蛋白ZO-1在类器官中未受BBR调节,提示其对不同紧密连接组分的调控具有选择性。
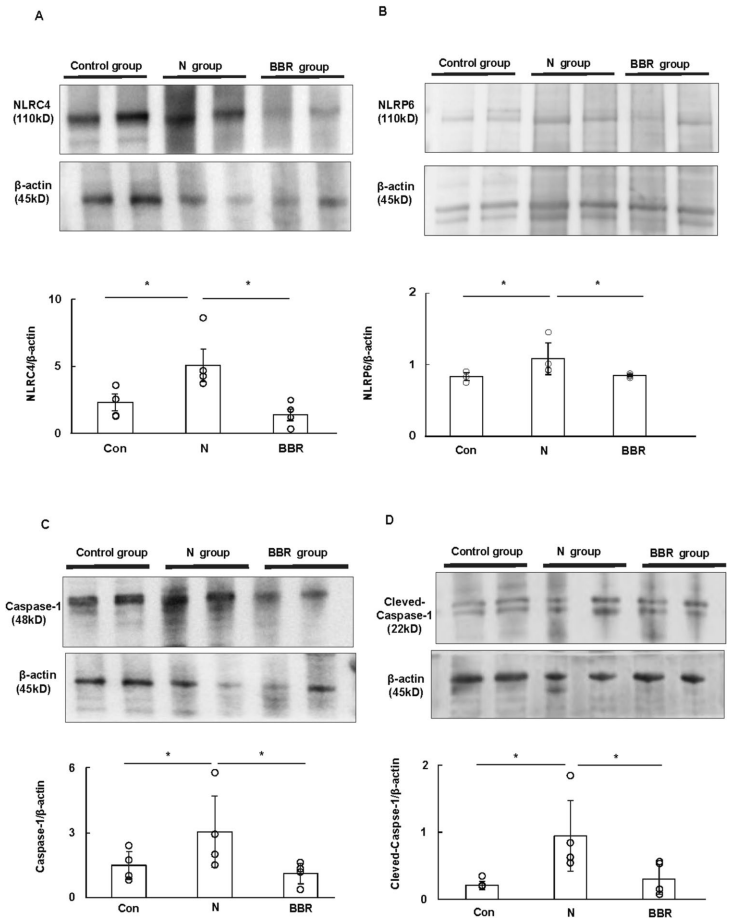
BBR特异性抑制炎症小体激活通路
Western blot分析显示,BBR使回肠组织NLRP6和NLRC4蛋白表达分别降低54%和61%,同时抑制Caspase-1剪切活化(减少68%)。这种抑制作用具有高度选择性——经典炎症小体NLRP3的表达未受影响。相应的,BBR处理组血清IL-1β和TNF-α水平显著下降,证实其通过调控非经典炎症小体通路抑制过度炎症反应。
该研究首次系统阐明BBR防治NSAID肠病的分子机制:一方面通过维持Claudin-1/Occludin介导的物理屏障功能,减少细菌易位;另一方面选择性抑制NLRP6/NLRC4-Caspase-1炎症小体轴,阻断IL-1β/TNF-α等促炎因子的释放。特别具有临床意义的是,BBR在类器官中展现的直接上皮保护作用,提示其对免疫功能低下患者也可能有效。这些发现为开发NSAID肠病的靶向防治策略提供了重要理论依据,也使具有千年应用历史的传统中药小檗碱焕发出新的治疗价值。
 生物通微信公众号
生物通微信公众号
知名企业招聘