
-

生物通官微
陪你抓住生命科技
跳动的脉搏
整合系统生物学方法揭示精氨酸生物合成是白色念珠菌宿主感染过程中的代谢弱点
【字体: 大 中 小 】 时间:2025年08月05日 来源:Cell Communication and Signaling 8.9
编辑推荐:
本研究针对耐药性白色念珠菌(CAL)感染死亡率高达63.6%的临床困境,通过构建宿主-CAL整合代谢模型和条件特异性基因组尺度代谢模型(GSMM),结合体外共培养和体内小鼠系统性感染实验,首次发现精氨酸(Arg)生物合成通路的关键酶ALT1是CAL的代谢弱点。研究证实CAL通过脯氨酸中间体上调Arg合成以增强毒力,ALT1缺失显著降低菌株致病性,为抗真菌耐药问题提供了新靶点。
在侵袭性真菌感染领域,白色念珠菌(Candida albicans, CAL)造成的血流感染死亡率已攀升至63.6%,而现有抗真菌药物因耐药性问题疗效锐减。这种机会性病原体通过代谢重编程适应宿主环境,但其关键代谢弱点尚未明确。印度医学研究理事会国家生殖与儿童健康研究所(ICMR-NIRRCH)联合印度理工学院马德拉斯分校的研究团队在《Cell Communication and Signaling》发表的研究,创新性地采用系统生物学与实验验证相结合的策略,揭示了精氨酸生物合成通路在CAL致病中的核心作用。
研究团队运用三大关键技术:1)整合CAL代谢模型iRV781与人类Recon3D模型构建宿主-病原体互作模型;2)通过通量变异性分析(FVA)和基因必需性分析筛选关键代谢反应;3)结合阴道上皮细胞A-431共培养模型和小鼠系统性感染实验验证靶点。
结果部分主要发现:
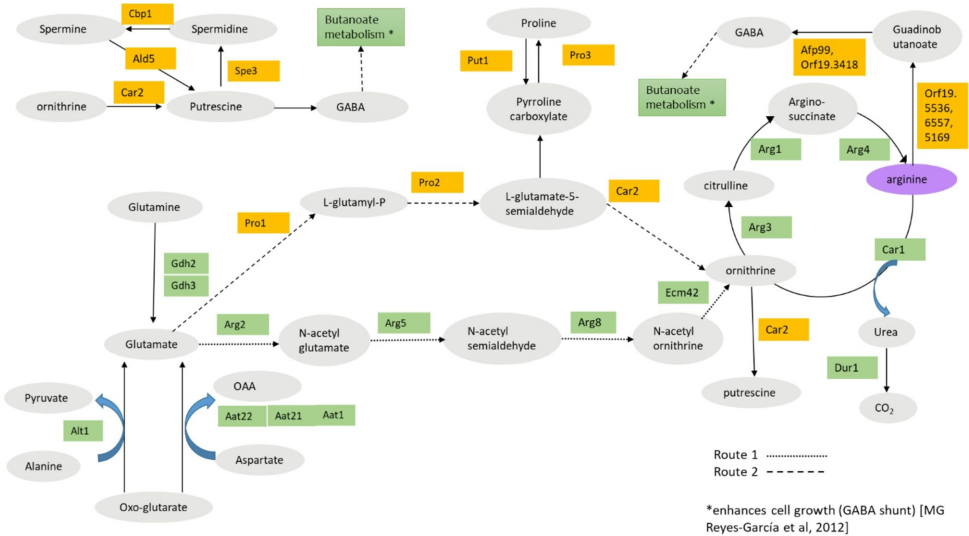
Context-specific GSMMs identify Arg metabolism as a crucial pathway in CAL infections
通过HUVEC细胞、OKF6口腔角质细胞和小鼠感染模型的转录组数据构建条件特异性GSMM,发现精氨酸生物合成是唯一在所有感染模型中均显著激活的通路,其通量跨度变化达20%以上。
Integrated host-pathogen models reveal ALT1 as a metabolic bottleneck
首创的宿主-CAL整合模型显示,阻断ALT1催化的ALATA_Lmm(线粒体丙氨酸转氨酶)反应时,CAL生长率下降40%,且宿主代谢无法补偿该缺陷。
Candida adapts to host stimuli by upregulating arginine synthesis
qPCR显示宿主接触5小时内,CAL通过脯氨酸中间体(GDH2/PRO2/CAR2)而非经典ARG基因途径上调Arg合成,细胞内Arg浓度增加3倍。
Prioritized targets in Arg metabolism exhibit variable in vivo expression patterns
PBITv3算法筛选的11个候选靶点中,ALT1虽在体内表达变化不显著,但其缺失突变体(MT)在小鼠模型中使存活率提升至100%,且显著降低菌丝形成和宿主组织损伤酶分泌。
这项研究的重要意义在于:首次通过代谢模型预测结合实验验证,证明CAL无法依赖宿主补偿Arg生物合成缺陷。ALT1作为通路关键节点,其缺失导致甘油磷脂代谢异常激活但仍无法挽救毒力衰减,这为开发针对代谢脆弱性的抗真菌策略提供了新思路。研究构建的宿主-CAL模型平台还可用于其他病原体-宿主互作研究,为多靶点药物开发奠定基础。

 生物通微信公众号
生物通微信公众号
知名企业招聘