
-

生物通官微
陪你抓住生命科技
跳动的脉搏
线粒体功能障碍驱动Barth综合征中性粒细胞减少的机制研究:基于患者定制化Tafazzin点突变小鼠模型的发现
【字体: 大 中 小 】 时间:2025年08月06日 来源:Stem Cell Reviews and Reports 4.2
编辑推荐:
本研究针对Barth综合征(BTHS)患者致命性中性粒细胞减少的机制空白,通过CRISPR/Cas9构建TAFAZZIN D75H点突变小鼠模型,首次揭示线粒体膜电位(Δψm)紊乱和活性氧(ROS)累积导致造血祖细胞功能受损是核心病理。印第安纳大学医学院团队发现TazD75H小鼠呈现年龄依赖的粒细胞生成障碍,并通过移植实验证实该表型源于TAZ酶活性缺失引发的细胞自主性缺陷,为靶向mPTP-CypD通路(如环孢素A)的临床干预提供了新依据。
研究背景与意义
Barth综合征(BTHS)作为一种罕见的X连锁线粒体疾病,困扰着全球数以千计的男性患者。这类患者不仅饱受心肌病和肌无力的折磨,更时刻面临着致命感染的威胁——其罪魁祸首便是反复发作的中性粒细胞减少。尽管临床上常用粒细胞集落刺激因子(G-CSF)暂时缓解症状,但约47%的患者仍会出现治疗抵抗。问题的关键在于,学界对TAFAZZIN(TAZ)基因突变如何破坏粒细胞生成的认知仍是一片迷雾。TAZ编码的心磷脂(CL)重构酶如同线粒体的"建筑师",其缺陷会导致线粒体结构和能量代谢的全面崩溃。然而,究竟是造血干细胞的自我更新受损,还是中性粒细胞前体的成熟障碍导致了这一血液学异常?这个谜题亟待破解。
研究设计与方法
印第安纳大学医学院(Indiana University School of Medicine)的Elizabeth A. Sierra Potchanant和Simon J. Conway团队独辟蹊径,采用CRISPR/Cas9基因编辑技术,将一位典型BTHS患者的TAZD75H点突变精准引入小鼠基因组,构建出全球首个稳定表达无催化活性TAZ蛋白的动物模型。研究人员通过多组学方法系统评估了突变小鼠的造血功能:
流式细胞术分析造血干细胞(HSC)和祖细胞群
甲基纤维素集落形成实验检测粒细胞-巨噬细胞祖细胞(GMP)分化潜能
骨髓移植实验验证细胞自主性缺陷
患者来源淋巴母细胞线粒体功能检测(JC-1和MitoSOX染色)
透射电镜观察线粒体超微结构
关键发现
造血功能的时间特异性紊乱
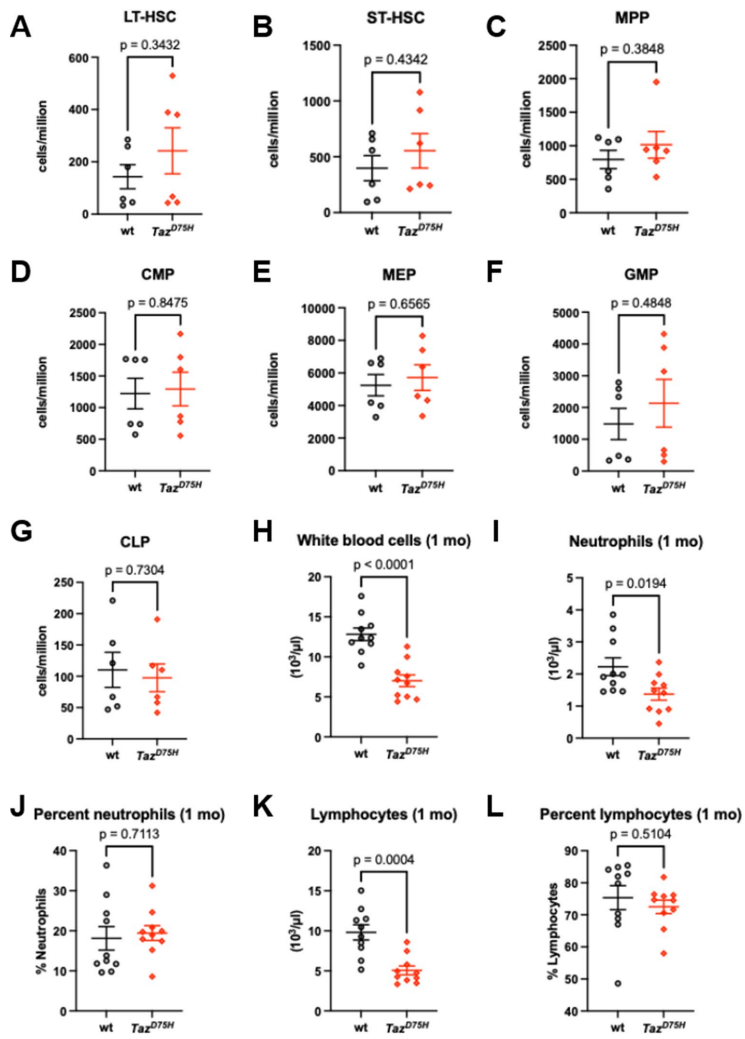
通过比较不同周龄小鼠的外周血象,研究团队捕捉到一个令人惊讶的现象:TazD75H雄性小鼠仅在新生儿期和幼年期(4周龄前)表现出显著的中性粒细胞减少,而成年后(8-10月龄)则恢复正常。这种年龄依赖的表型完美模拟了BTHS患者临床表现的异质性。
髓系祖细胞的隐形缺陷
尽管流式检测显示各类造血祖细胞数量正常,但集落形成实验揭露了惊人真相:TazD75H小鼠的GMP细胞产生粒细胞-巨噬细胞集落(CFU-GM)的能力下降40%。更关键的是,胸苷杀伤实验证实这些祖细胞处于异常的细胞周期停滞状态——这正是临床上G-CSF治疗反应差异的潜在解释。
线粒体危机的分子证据
JC-1染色显示突变型造血细胞的线粒体膜电位(Δψm)普遍降低30%,而患者淋巴母细胞中MitoSOX阳性细胞增加1.5倍。电镜照片更直观展现了线粒体肿胀、嵴结构紊乱的病理特征。当用环孢素A(CsA)阻断线粒体通透性转换孔(mPTP)时,这些异常被显著逆转,这为靶向干预提供了直接证据。
临床启示与展望
这项研究首次阐明TAZ酶活性缺失通过"线粒体功能障碍-ROS累积-祖细胞周期阻滞"的三联机制导致BTHS血液学异常。特别值得注意的是,骨髓移植实验证实成年小鼠的中性粒细胞减少具有可逆性,这提示新生儿期可能是干预的黄金窗口。研究者提出的CsA治疗方案已在小鼠模型和患者细胞中得到概念验证,其通过稳定Δψm和减少氧化应激的双重作用机制,有望成为G-CSF的替代疗法。
该成果的深远意义还在于:为其他线粒体疾病相关的血细胞减少症(如Pearson综合征)提供了研究范式;揭示心磷脂代谢在造血干细胞稳态维持中的新角色;建立的TazD75H小鼠模型将成为未来药物筛选的重要平台。正如论文通讯作者Simon J. Conway强调的:"这不是简单的基因缺失模型,而是真实模拟患者突变蛋白功能的活体研究系统"。随着对TAZ非酶功能的深入探索,BTHS的治疗策略或将迎来全新突破。
 生物通微信公众号
生物通微信公众号
知名企业招聘