
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基因治疗新突破:SPVN06为杆锥细胞营养不良症提供突变非依赖性治疗策略
【字体: 大 中 小 】 时间:2025年08月06日 来源:Gene Therapy 4.5
编辑推荐:
本研究针对杆锥细胞营养不良症(RCD)这一遗传异质性极高的致盲性疾病,开发了基于AAV8载体的基因疗法SPVN06。通过同时递送杆源锥细胞存活因子RdCVF及其长异构体RdCVFL,该研究在rd10/rd10小鼠模型中证实了视力保护效果,并在非人灵长类动物中验证了6.0×1010 vg/眼剂量下的安全性。这项突破性研究为超过100种基因突变导致的RCD提供了通用治疗方案,相关成果已进入I/II期临床试验(NCT05748873)。
在遗传性视网膜疾病领域,杆锥细胞营养不良症(RCD)犹如一道无解的难题——全球150万患者中,每人可能携带超过100种不同基因的突变,导致进行性视力丧失。这种疾病的残酷之处在于:即便致病基因不同,所有患者最终都会经历相同的悲剧——先是负责夜视的杆细胞死亡,继而失去色彩和中心视力的锥细胞相继凋亡。面对如此复杂的遗传异质性,传统"一对一"的基因替代疗法显得力不从心,因为每种突变都需要单独开发治疗方案。
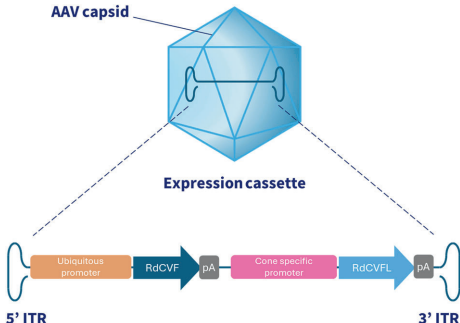
SparingVision的研究团队另辟蹊径,将目光聚焦在疾病进展的共同通路上。他们发现,无论初始突变如何,RCD患者都会面临两个关键病理过程:存活的锥细胞因失去杆细胞分泌的存活因子(RdCVF)而"饿死",同时因缺乏抗氧化蛋白RdCVFL而"氧化中毒"。基于这一认识,团队开发了革命性的SPVN06疗法——通过单次亚视网膜注射AAV8载体,同时递送RdCVF(促进锥细胞糖代谢)和RdCVFL(抵抗氧化损伤),实现对多种RCD亚型的"全覆盖"治疗。
研究采用多学科技术组合:在rd10/rd10小鼠模型中通过视动跟踪(OKT)评估视觉功能;在非人灵长类动物中进行13周GLP毒理研究,包括全视野视网膜电图(ffERG)和光学相干断层扫描(OCT)监测;采用定量PCR(qPCR)和原位杂交分析载体分布;通过免疫组化评估视网膜结构完整性。特别值得注意的是,所有实验均采用临床级生产工艺的载体,并建立了区分内源性与治疗性RdCVF/RdCVFL mRNA的检测方法。
药理活性验证
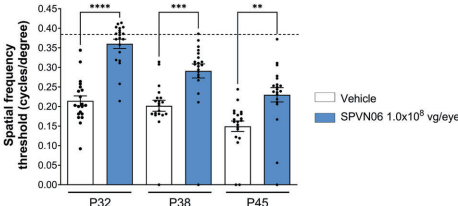
在黑暗饲养的rd10/rd10小鼠中,1.0×108 vg/眼的SPVN06治疗使视功能维持在野生型水平,qPCR检测显示视网膜中持续表达治疗性RdCVF(8.7×106拷贝/μg RNA)和RdCVFL(1.87×106拷贝/μg RNA)。视动跟踪测试显示,治疗组空间频率阈值显著高于对照组(p<0.0001),证明其能有效阻断疾病进展。
安全性与分布特征
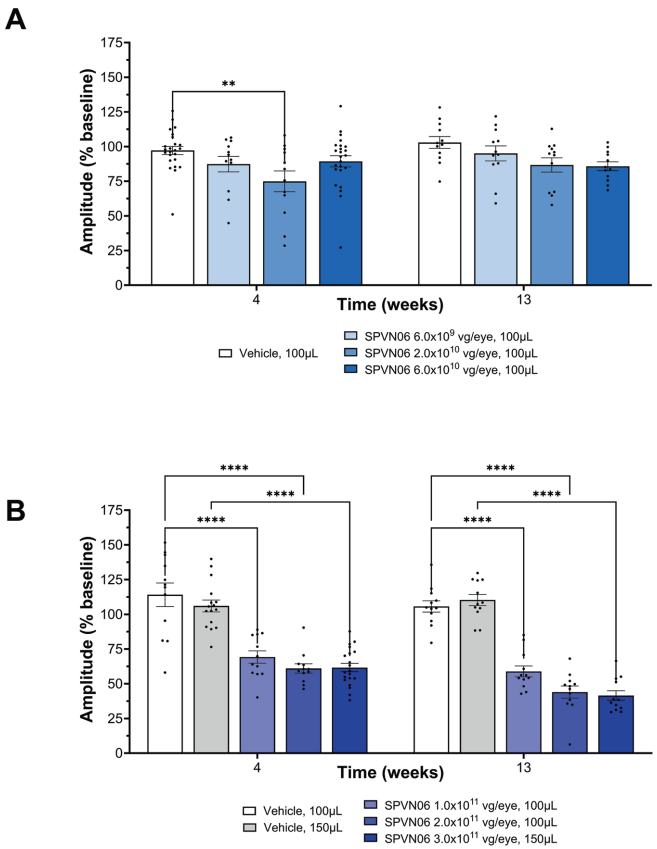
非人灵长类研究显示,6.0×1010 vg/眼剂量下未观察到不良反应。载体DNA主要局限在眼内,视网膜bleb区浓度达7.87×106拷贝/μg DNA,且稳定表达治疗基因至13周。值得注意的是,RdCVFL表达在≥1.0×1011 vg/眼剂量时出现平台效应,提示可能存在反馈调节机制。
剂量限制性毒性
高剂量组(≥1.0×1011 vg/眼)出现剂量依赖性视锥功能减退(ffERG波幅下降42-51%),组织学证实这与视网膜色素上皮(RPE)和光感受器损失相关。研究者推测这可能是由于健康灵长类视网膜中过量的RdCVF/RdCVFL破坏了氧化还原平衡,该效应在缺乏内源因子的患者中可能不会出现。
这项研究的意义在于:首次证实通过靶向疾病共同通路,可绕过遗传异质性障碍开发"通用型"RCD疗法。SPVN06的独特设计使其既能挽救"饥饿"的锥细胞(通过RdCVF激活葡萄糖转运体1),又能清除毒性氧自由基(通过RdCVFL的硫氧还蛋白活性),这种双机制协同作用为晚期患者提供了治疗窗口。目前基于这些数据开展的PRODYGY临床试验(NCT05748873)初步结果积极,标志着视网膜基因治疗从"精准医疗"向"广谱治疗"的重要转变。
 生物通微信公众号
生物通微信公众号
知名企业招聘